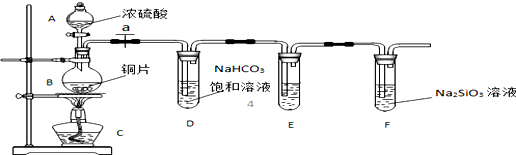
题目内容
3.A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断: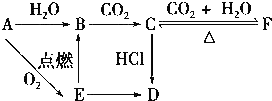
(1)写出A、B、C、D、E、F的化学式:
B.NaOH;C.Na2CO3;D.NaCl;E.Na2O2;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
E→B:2Na2O2+2H2O=4Na++4OH-+O2↑,
C→F:CO32-+H2O+CO2=2HCO3-,
F→C:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(3)下列实验方案中,不能准确测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体直接用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
分析 A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与二氧化碳得到C,C与二氧化碳、水反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且能由过氧化钠转化得到,可推知D为NaCl,据此解答.
解答 解:A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与二氧化碳得到C,C与二氧化碳、水反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且能由过氧化钠转化得到,可推知D为NaCl,
(1)由上述分析可知,B为NaOH,C为Na2CO3、D为NaCl,E为Na2O2,
故答案为:NaOH;Na2CO3;NaCl;Na2O2;
(2)E→B是过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
C→F是碳酸钠与二氧化碳、水反应生成碳酸氢钠,反应离子方程式为:CO32-+H2O+CO2=2HCO3-,
F→C是碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;CO32-+H2O+CO2=2HCO3-;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)A、在Na2CO3和NaHCO3中,加热能分解的只有NaHCO3,根据NaHCO3的质量进行计算,故A正确;
B、反应后加热、蒸干、灼烧得到的固体产物是NaCl,Na2CO3和NaHCO3转化为NaCl时的固体质量变化不同,由钠元素守恒和质量关系,可列方程组计算,故B正确;
C、碱石灰可以同时吸收CO2和水蒸气,则无法计算,故C错误;
D、Na2CO3和NaHCO3转化为BaCO3时的固体质量变化不同,利用质量关系来计算,故D正确;
故选C.
点评 本题考查无机物推断,涉及钠元素单质及其化合物的转化,突破口为“E为淡黄色粉末及由A与氧气在点燃条件下得到”,再结合转化关系推断,注意基础知识的掌握,题目难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
| A. | 2mol/LAgNO3溶液 | B. | 2mol/LNaOH溶液 | C. | 2mol/LMgSO4溶液 | D. | Fe(OH)3胶体 |
| A. | 酸性由强到弱的顺序为HCN>HClO>CH3COOH | |
| B. | 0.1mol?L-1 NaClO溶液的碱性一定比0.1 mol?L-1 CH3COONa强 | |
| C. | 等物质的量浓度的CH3COONa溶液和醋酸溶液都促进了水的电离 | |
| D. | a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合,溶液中c(Na+)=c(CN-),则a=b |
| A. | N2的电子式: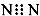 | B. | 钠离子的结构示意图: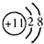 | ||
| C. | 乙烯的结构式:C2H4 | D. | CO2的比例模型: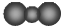 |
| A. | NaOH溶液 | B. | 饱和Na2CO3溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和氯化钠溶液 |
| A. | MnO2→MnSO4 | B. | Na2O2→O2 | C. | KI→KIO3 | D. | AlCl3→Al(OH)3 |