题目内容
(1)在一定温度下,向容器为2L的真空容器内(装有催化剂),通入2molSO2和1molO2,2min后测得容器内的压强是开始时的0.8(即2min时气体总物质的量与开始气体的总物质的量之比),求此时容器内SO2的转化率?(写出计算过程)
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)
CO2(g)+H2(g);△H<0
已知该温度下的化学平衡常数为1.
①某时刻测得CO的浓度为0.22mol/L,H2O的浓度为0.12mol/L,CO2的浓度为0.08mol/L,H2的浓度为0.08mol/L,此时该反应是否处于化学平衡状态 (填“是”、或“否”),此时反应速率是V正 V逆(填“大于”、“小于”或“相等”),请写出计算过程说明你的结论.
②平衡时,再加入水蒸气,经过一段时间重新达到新平衡,这时CO的转化率 ,
H2O的转化率 (均填“增大”、“减小”或“不变”).
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)
| 0.08mol/L×0.08mol/L |
| 0.22mol/L×0.12mol/L |
已知该温度下的化学平衡常数为1.
①某时刻测得CO的浓度为0.22mol/L,H2O的浓度为0.12mol/L,CO2的浓度为0.08mol/L,H2的浓度为0.08mol/L,此时该反应是否处于化学平衡状态
②平衡时,再加入水蒸气,经过一段时间重新达到新平衡,这时CO的转化率
H2O的转化率
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)利用三段式计算,设反应掉的氧气为xmol,利用压强之比等于物质的量之比,可以求得2min后各成分的物质的量,进而求得转化率;
(2)①根据浓度商与平衡常数的大小关系可以答题;
②根据影响平衡移动的外界因素可以作判断.
(2)①根据浓度商与平衡常数的大小关系可以答题;
②根据影响平衡移动的外界因素可以作判断.
解答:
解:(1)2SO2+O2  2SO3
2SO3
n开始(mol) 2 1 0
△n(mol) 2x x 2x
n2min(mol)2-2x 1-x 2x
由题意可得,
=0.8 x=0.6
所以二氧化硫的转化率为
×100%=60%
答:此时容器内SO2的转化率为60%;
(2)①因为Qc=
=
=
<K=1,所以平衡向右移动,即正反应速率大于逆反应速率,故答案为:否;大于;
②因为CO和H2O都是可逆反应的反应物,对于可逆反应,平衡时,根据平衡移动的原理分析可知,增加一种反应物的浓度可以提高另一种反应物的转化率,而自身的转化率下降,故答案为:增大;减小.
 2SO3
2SO3n开始(mol) 2 1 0
△n(mol) 2x x 2x
n2min(mol)2-2x 1-x 2x
由题意可得,
| 3-x |
| 3 |
所以二氧化硫的转化率为
| 1.2 |
| 2 |
答:此时容器内SO2的转化率为60%;
(2)①因为Qc=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 0.08mol/L×0.08mol/L |
| 0.22mol/L×0.12mol/L |
| 8 |
| 33 |
②因为CO和H2O都是可逆反应的反应物,对于可逆反应,平衡时,根据平衡移动的原理分析可知,增加一种反应物的浓度可以提高另一种反应物的转化率,而自身的转化率下降,故答案为:增大;减小.
点评:本题主要考查了化学平衡的计算以及运用平衡常数判断反应进行的方向,难度不大,解题时要注意对基本原理的理解和应用.

练习册系列答案
相关题目
最不适宜于制作炊事用具的金属是( )
| A、Fe | B、Pb | C、Al | D、Cu |
霉酚酸是一种生物活性化合物.下列有关霉酚酸的说法正确的是( )
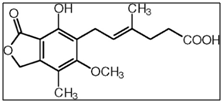

| A、分子式为:C17H18O6 |
| B、处于同一平面的碳原子至多9个 |
| C、不能与FeCl3溶液发生显色反应 |
| D、一定条件下1mol霉酚酸最多可与3mol NaOH反应 |
2009年5月25日朝鲜进行二次核试验遭到了世界人民的强烈谴责,朝鲜因拥有丰富的铀矿而具有进行核能研究的天然条件.下列有关铀元素的说法中,错误的是( )
| A、234U、235U、238U是3种原子 | ||
B、
| ||
C、
| ||
D、
|

 用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.