题目内容
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中发生反应的化学方程式为:_______________;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:___________________;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量将_________(填“偏高”、“偏低”或“无影响”);
(4)下列试剂中,可以用来替代洗气瓶C中溶液的是_________。(选填字母编号)
a.NaOH溶液 b.品红溶液
c.酸性高锰酸钾溶液 d.Na2CO3溶液
乙方案:实验步骤如以下流程图所示:

(5)写出步骤②中反应的离子方程式;_________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________________(用含V、m的代数式表示)
【答案】 SO2+I2+2H2O=H2SO4+2HI 增大SO2和碘水的接触面积 偏低; c Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ![]()
【解析】本题考查实验方案设计与评价,(1)I2的氧化性强于SO2,洗气瓶中发生的化学反应方程式为SO2+I2+2H2O=H2SO4+2HI;(2)增加SO2与I2的接触面积,使之充分被吸收;(3)没有及时关闭活塞A,造成尾气体积增大,即总体积增大,而蓝色溶液消失,说明I2恰好完全反应,即所测的SO2的含量将偏低;(4)I2的淀粉溶液显蓝色,当蓝色恰好消失,说明反应完全进行,因此能够代替洗气瓶C中溶液,必须有明显现象,a、NaOH与SO2反应没有明显现象,因此不能用NaOH代替,故a错误;b、SO2虽然能使品红溶液褪色,但品红溶液只是验证SO2的存在,不能吸收SO2,无法计算SO2的含量,故b错误;c、酸性高锰酸钾溶液具有强氧化性,能把SO2氧化成SO42-,且紫红色褪去,因此可以用高锰酸钾溶液代替,故c正确;d、SO2与Na2CO3产生CO2,根据此装置无法计算SO2的含量,故d错误;(5)反应①发生的离子反应是H2O2+SO2=2H++SO42-,加入过量Ba(OH)2溶液,则反应②的离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;(6)根据过程最后得到固体为BaSO4,根据硫酸守恒,n(SO2)=n(BaSO4)=m/233mol,则SO2含量为22.4m/233V。

【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:將Fe3+转化为Fe2+
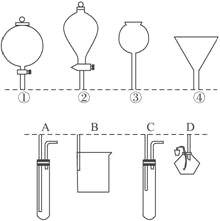
(1)Fe3+与Cu粉发生反应的离子方程式为___________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4溶液与KSCN溶液 反应产生了白色沉淀 |
取______________ | 无明显现象 |
查阅资料:
已知:①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.lmol/LFeSO4溶液中加入1mL 稀硝酸 | 溶液变为棕色,放置一段时间后, 棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2++与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II_____(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因_______________________________。
【题目】[化学-选修3:物质结构与性质]
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)硅元素基态原子的价电子轨道表示式为____________。
(2)第四周期中,与铝未成对电子数相同的金属元素有________种。
(3)Na+和Ne互为等电子体,电离能I2(Na)________I1(Ne)(填“>”或“<”)。
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
HClO4的结构简式为_________,HClO3中Cl原子的杂化轨道类型为________,HClO2中含有的共价键类型为__________。以上几种含氧酸的酸性强弱不同,其原因为______________。
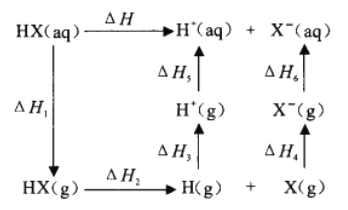
②氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为_________,影响ΔH2递变的因素为______________。
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA。则铝单质的密度为________g·cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为____________。