��Ŀ����
����Ŀ��ͨ����������ʵ��ⶨ���ᾧ�壨H2C2O4��xH2O���нᾧˮx��ֵ��
�ٳ�ȡ2.52 g���ᾧ�壬���Ƴ�100 .00 mL��Һ��
��ȡ25.00 mL������Һ������ƿ�У���������ϡ�������Ũ��Ϊ0.100 mol��L-1 KMnO4��Һ���еζ����䷴Ӧԭ���ǣ�2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
��ش��������⣺
��1��ʵ����У�KMnO4Ӧװ��______�ζ����У�������ʽ��������ʽ������
��2����ͼ��ʾ50mL�ζ�����Һ���λ�ã����Һ�洦�Ķ�����a����ζ�����Һ������______��
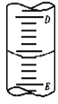
A����amL B���ǣ�50��a)mL
C��һ������amL D��һ�����ڣ�50��a��mL
��3���жϴﵽ�ζ��յ��������_____________________________��
���ζ��յ�ʱ������ȥKMnO4��Һ20.00 mL����x =__________��
��4�����ڵ���KMnO4��Һ֮ǰ�ζ��ܵļ��첿�������ݣ��ζ�������������ʧ�����ʹ�ⶨ���______��ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
���𰸡� ��ʽ D �������һ��KMnO4��Һʱ����Һ��Ϊ��ɫ(��dz�ϻ��Ϻ�)���Ұ��������ɫ�������仯 2 ƫ��
��������������Ҫ����ζ�������
��1��ʵ����У�KMnO4��ҺӦװ����ʽ�ζ����У�����KMnO4��Һ��ʴ�ܡ�
��2��50mL�̶������»���Һ�壬���Һ�洦�Ķ�����a����ζ�����Һ������һ�����ڣ�50��a��mL����ѡD��
��3���жϴﵽ�ζ��յ�������ǵ������һ��KMnO4��Һʱ����Һ��Ϊ��ɫ���Ұ��������ɫ�������仯��
2KMnO4��5H2C2O4��n(H2C2O4)=2.5n(KMnO4)=2.5(0.100molL -1 ��20.00mL)=5.00mmol��M(H2C2O4)=2.52g/4/5.00mmol=126g/mol����x =2��
��4��KMnO4��Һ�����ֵ����ʹ�ⶨ���ƫ�ߡ�

����Ŀ�����г����Լ�ѡ����ȷ����
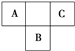
ѡ�� | ���ᴿ���� | ���� | �����Լ� |
A | Cl2 | HCl | NaOH��Һ |
B | CO2 | CO | O2 |
C | FeCl3��Һ | FeCl2 | Cl2 |
D | Na2CO3 | NaHCO3 | ���� |
A. A B. B C. C D. D