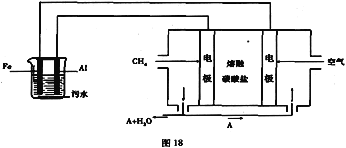
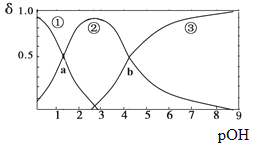
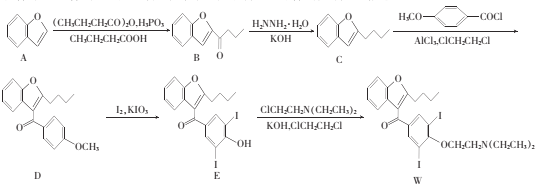
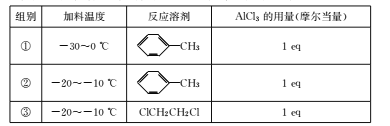
题目内容
【题目】把m mol乙烯跟n mol H2混合于一密闭容器中,在适当条件下反应并生成p mol C2H6,若将所得的混合气体燃烧,并全部生成CO2和H2O,需要氧气的物质的量(单位:mol)为
A.3m+nB.![]()
C.![]() D.3m+
D.3m+![]() -3p
-3p
【答案】B
【解析】
根据原子守恒可以知道,生成CO2中C来自于乙烯,H2O中H来自于乙烯和H2,据此分析。
反应前后C原子和H原子的物质的量没有发生变化,则混合气体的耗氧量即是mmolC2H4和nmolH2的耗氧量,根据CO2和H2O,推出1molC消耗1molO2,1molH消耗![]() molO2,因此mmolC2H4和nmolH2的耗氧量是[2m+(4m+2n)×
molO2,因此mmolC2H4和nmolH2的耗氧量是[2m+(4m+2n)×![]() ]mol=(3m+0.5n)mol,故B正确;
]mol=(3m+0.5n)mol,故B正确;
答案:B。

练习册系列答案
相关题目