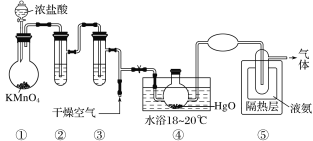
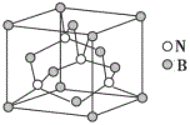
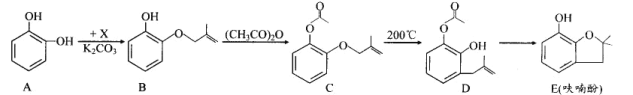
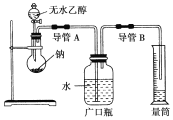
题目内容
【题目】单一盐溶液中离子浓度比较
(1)NH4Cl溶液中存在的水解平衡是________,使c(H+)___c(OH-)、c(Cl-)_____c(NH4+),盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度_______水解产生的OH-的浓度。所以溶液中离子浓度大小关系是________。
(2)Na2CO3溶液中存在的水解平衡是__________、_______离子浓度大小关系是_________。
【答案】NH4++H2O![]() NH3·H2O+H+ > > > c(Cl-)>c(NH4+)>c(H+)>c(OH-) CO32-+H2O
NH3·H2O+H+ > > > c(Cl-)>c(NH4+)>c(H+)>c(OH-) CO32-+H2O![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O![]() H2CO3+OH- c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
H2CO3+OH- c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
【解析】
(1) NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应,结合盐的水解规律,书写水解的离子方程式,根据物料守恒判断离子浓度大小;
(2)Na2CO3是强碱弱酸盐,在溶液中弱酸根离子发生水解,由于碳酸是二元碳酸,所以碳酸根离子水解分步进行,根据物料守恒和盐的水解规律比较离子浓度大小。
(1) NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应,水解的离子方程式:NH4++H2O![]() NH3·H2O+H+,当最终达到平衡时,溶液中c(H+)>c(OH-),NH4+由于水解而消耗,因此c(Cl-)>c(NH4+);但盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度远大于水解产生的c(OH-),盐电离产生的离子浓度大于水电离产生的离子浓度,因此溶液中各种离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
NH3·H2O+H+,当最终达到平衡时,溶液中c(H+)>c(OH-),NH4+由于水解而消耗,因此c(Cl-)>c(NH4+);但盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度远大于水解产生的c(OH-),盐电离产生的离子浓度大于水电离产生的离子浓度,因此溶液中各种离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)Na2CO3是强碱弱酸盐,根据盐的组成可知c(Na+)>c(CO32-),在溶液中弱酸根离子CO32-发生水解反应,但碳酸根离子水解分步进行,首先是CO32-+H2O![]() HCO3-+OH-,水解产生的HCO3-进一步发生水解作用:HCO3-+ H2O
HCO3-+OH-,水解产生的HCO3-进一步发生水解作用:HCO3-+ H2O![]() H2CO3+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),盐水解程度是微弱的,水解产生的离子浓度远小于盐电离产生的离子浓度,所以c(CO32-)>c(HCO3-),OH-由CO32-、HCO3-水解产生,且溶液中水电离也产生OH-,所以溶液中c(OH-)>c(HCO3-),盐水解产生的HCO3-离子浓度大于水电离产生的H+的浓度,故最终该溶液中各种离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。
H2CO3+OH-,当最终达到平衡时,溶液中c(OH-)>c(H+),盐水解程度是微弱的,水解产生的离子浓度远小于盐电离产生的离子浓度,所以c(CO32-)>c(HCO3-),OH-由CO32-、HCO3-水解产生,且溶液中水电离也产生OH-,所以溶液中c(OH-)>c(HCO3-),盐水解产生的HCO3-离子浓度大于水电离产生的H+的浓度,故最终该溶液中各种离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)。