题目内容
【题目】其它燃料电池负极(燃料)电极反应式的书写
(1)烃燃料电池
①酸性介质
CH4:1CH4—8 e—+2H2O= 1CO2+8H+
C2H6 :____________
C2H2 : ___________
②碱性介质
CH4:1CH4—8 e—+ 10OH—= 1 CO32—+ 7 H2O
C2H6:1 C2H6—14e— + 18OH—= 2CO32—+12H2O
C2H2:______________
(2)烃的含氧衍生物燃料电池
①酸性介质
CH3OH:1CH3OH—6e—+1H2O = 1CO2+6 H+
C2H5OH: ______________
CH3OCH3:_____________
②碱性介质
CH3OH: 1CH3OH—6e—+8OH —= 1CO32—+ 6 H2O
C2H5OH: ___________
CH3OCH3:___________
(3)熔融碳酸盐为电解质
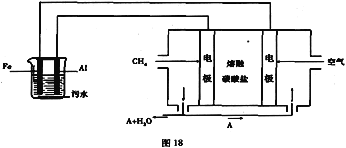
负极(CH4):___________
正极(O2):______________
【答案】1 C2H6-14e-+4H2O= 2CO2+14H+ 1 C2H2-10e-+4H2O= 2CO2+10H+ 1 C2H2-10e- + 14OH-= 2CO32-+8H2O 1 C2H5OH-12e-+3H2O = 2CO2+12 H+ 1 CH3OCH3-12e-+3H2O = 2CO2+12 H+ 1 C2H5OH-12e—+16OH —= 2CO32—+ 11 H2O 1 CH3OCH3-12e—+16OH —= 2CO32—+ 11 H2O CH4+4CO328e=5CO2+2H2O O2+2CO2+4e=2CO32
【解析】
根据燃料电池原理分析正负极,书写电极反应式时,负极失去电子发生氧化反应,根据元素化合价变化计算失电子数目,根据电荷守恒及电解质溶液中存在的离子对反应式进行缺项配平即可。
(1)乙烷和乙炔在反应中产物和甲烷相同,只是失去电子数目不同,可以根据化合价的变化计算失去电子的数目,如甲烷中C为-4价,电极反应中生成CO2或CO32-,C元素化合价为+4,则失去8个电子,再根据电荷守恒及原子配平反应式即可;则:
①酸性介质
CH4:1CH4-8 e-+2H2O= 1CO2+8H+
C2H6 :1 C2H6-14e-+4H2O= 2CO2+14H+
C2H2 :1 C2H2-10e-+4H2O= 2CO2+10H+
②碱性介质
CH4:1CH4-8 e-+ 10OH-= 1 CO32-+ 7 H2O
C2H6:1 C2H6-14e- + 18OH-= 2CO32-+12H2O
C2H2:1 C2H2-10e- + 14OH-= 2CO32-+8H2O
故答案为: 1 C2H6-14e-+4H2O= 2CO2+14H+;1 C2H2-10e-+4H2O= 2CO2+10H+;1 C2H2-10e- + 14OH-= 2CO32-+8H2O;
(2)烃的含氧衍生物燃料电池
①酸性介质
CH3OH:1CH3OH-6e-+1H2O = 1CO2+6 H+
C2H5OH:1 C2H5OH-12e-+3H2O = 2CO2+12 H+
CH3OCH3:1 CH3OCH3-12e-+3H2O = 2CO2+12 H+
②碱性介质
CH3OH: 1CH3OH-6e—+8OH —= 1CO32—+ 6 H2O
C2H5OH: 1 C2H5OH-12e—+16OH —= 2CO32—+ 11 H2O
CH3OCH3:1 CH3OCH3-12e—+16OH —= 2CO32—+ 11 H2O
故答案为:1 C2H5OH-12e-+3H2O = 2CO2+12 H+;1 CH3OCH3-12e-+3H2O = 2CO2+12 H+;1 C2H5OH-12e—+16OH —= 2CO32—+ 11 H2O;1 CH3OCH3-12e—+16OH —= 2CO32—+ 11 H2O;
(3)料电池中,正极反应一定是氧气得电子,该电池的电解质环境是熔融碳酸盐,所以正极反应为:O2+2CO2+4e=2CO32;负极反应是CH4失电子;该电池的电解质环境是熔融碳酸盐;所以负极反应为:CH4+4CO328e=5CO2+2H2O;电池是以熔融碳酸盐为电解质,可以循环利用的物质是二氧化碳,故答案为:CH4+4CO32

【题目】(1)羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中。在酸性溶液中可用H2O2氧化COS生成一种强酸(脱硫反应)该脱硫反应的化学方程式为________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=+11kJ·mo-1;
H2S(g)+CO(g)△H1=+11kJ·mo-1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-21kJ·mol-l;
H2(g)+CO2(g) △H2=-21kJ·mol-l;
③COS(g)+H2O(g)![]() H2S(g)+ CO2(g) △H3=________
H2S(g)+ CO2(g) △H3=________
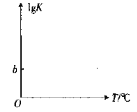
(3)用活性a-Al2O3催化COS水解,反应为 COS(g)+H2O(g)![]() CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。
CO2(g)+H2S(g)在催化剂表面停留时间相同时,不同温度下COS的转化率如图所示。

由图可知,COS的转化率在后期下降的原因可能是________ 。
(4)COS可由CO和H2S在一定条件下反应制得,在刚性容器中发生反应:CO(g)+H2S(g)=COS(g) + H2(g)△H<0。初始时各物质的物质的量浓度与平衡时CO的物质的量浓度数据如下表所示:
实验 | 温度/℃ | 起始时/ molL-1 | 平衡时/ molL-1 | |||
c(CO) | c(H2S) | c(COS) | c(H2) | c(CO) | ||
Ⅰ | T1 | 20.0 | 20.0 | 0 | 0 | 16.0 |
Ⅱ | T2 | 10.0 | 10.0 | 0 | 0 | 7.0 |
Ⅲ | T3 | 7.0 | 8.0 | 2.0 | 4.5 | |
①T1_____(填“大于”“小于”或“等于”)T2。
②实验I中,8 min反应达到平衡,则08 min内v(COS)= _____molL-1,T![]() 时,该反应的平衡常数为_____。
时,该反应的平衡常数为_____。
③实验Ⅲ中的反应应_____(填“正向”或“逆向”)移动。
(5)反应COS(g)+H2(g)=H2S(g)+CO(g)的平衡常数K与温度T的关系式为lgK=aT+b(a,b均为常数),请在如图所示的坐标系中用直线画出lgK与温度T的关系图像_____。
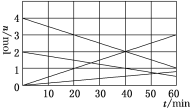
【题目】CO、SO2是常见的大气污染物,应用化学原理变废为宝,意义重大。
(1)CO与SO2用铝矾土作催化剂、475 ℃条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应过程中各组分的物质的量与反应时间的关系如图所示,该反应的化学方程式为________。
(2)利用CO可以合成新能源物质——甲醇。其原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
CH3OH(g) ΔH。在压强分别为p1、p2,体积均为V L的两个容器中充入a mol CO、2a mol H2,在催化剂作用下反应生成甲醇,平衡时转化率与温度、压强的关系有下表数据:
50 ℃ | 100 ℃ | 200 ℃ | 300 ℃ | 400 ℃ | |
p1 | 0.65 | 0.50 | 0.40 | 0.32 | 0.24 |
p2 | 0.80 | 0.70 | 0.65 | 0.50 | 0.41 |
①ΔH________0,p1________p2。(填“>”“<”或“=”)。
②压强为p2,温度为300 ℃时,该反应的平衡常数K=________。
③压强为p1,温度为100 ℃时,达到平衡后,继续向其中通入0.5a mol CO、a mol H2、0.5a mol CH3OH,则平衡时CH3OH的体积分数________(填“增大”“减小”或“不变”)。
④下列说法正确的是________。
a.当n(CO)∶n(H2)∶n(CH3OH)=1∶2∶1时,可逆反应达到平衡状态
b.平衡后向体积为V L的容器内继续充入He,平衡不移动
c.使用新型催化剂,可提高CO的平衡转化率
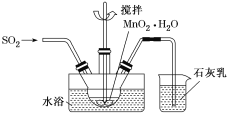
(3)MnO2悬浊液、NaOH溶液都是SO2气体常用的吸收剂。
①已知MnO2+SO2=MnSO4,吸收SO2的装置如图所示。反应过程中,为使SO2尽可能转化完全,可采取的合理措施有___________、__________。
②将标准状况下4.48 L SO2气体缓缓通入100 mL 3 mol·L-1 NaOH溶液中,充分反应后c(Na+)=___ (填几种粒子浓度之和)。
③取②中所得溶液10 mL,加水稀释成1 L,向其中加入CaCl2固体至有沉淀CaSO3(Ksp=3.1×10-7)生成,则所加CaCl2固体的质量为_____mg。