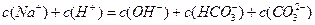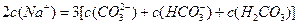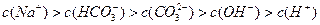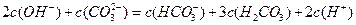题目内容
常温下某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合溶液的pH如下表:
(1)不考虑其他组的实验情况,单从甲组分析如何用a来分析HA属于强酸还是弱酸:_____。
(2)不考虑其他组的实验情况,单从乙组分析c是否一定等于0.2?________。混合溶液中离子浓度c(A-)与c(Na+)的大小关系为________。
(3)从丙组结果分析HA是________酸,该混合溶液中离子浓度大小关系为________。
(4)丁组实验混合溶液中由水电离的c(OH-)=_____________mol·L-1。
| 实验编号 | HA的浓度(mol·L-1) | NaOH的浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其他组的实验情况,单从乙组分析c是否一定等于0.2?________。混合溶液中离子浓度c(A-)与c(Na+)的大小关系为________。
(3)从丙组结果分析HA是________酸,该混合溶液中离子浓度大小关系为________。
(4)丁组实验混合溶液中由水电离的c(OH-)=_____________mol·L-1。
(1)若a=7,HA为强酸,若a>7,HA为弱酸
(2)否 c(A-)=c(Na+)
(3)弱c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5
(2)否 c(A-)=c(Na+)
(3)弱c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5
甲实验中酸和碱恰好完全反应生成NaA盐溶液,若a=7,HA为强酸,若a>7,HA为弱酸。乙实验中如果HA为强酸,c=0.2 mol·L-1,若HA为弱酸,c>0.2 mol·L-1。pH=7说明溶液显中性,c(H+)=c(OH-),由电荷守恒可知,c(A-)=c(Na+)。丙组实验时HA过量的情况下混合液显碱性说明HA为弱酸。混合溶液中c(H+)<c(OH-),溶液中离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)。常温下KW=10-14,所以当混合溶液的pH=9时,由水电离的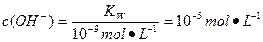 。
。
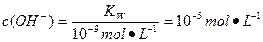 。
。
练习册系列答案
相关题目

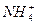 )=c(Na+)=c(OH-)>c(NH3·H2O)
)=c(Na+)=c(OH-)>c(NH3·H2O)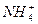 )
)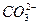 )+c(
)+c(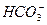 )+c(H2CO3)
)+c(H2CO3)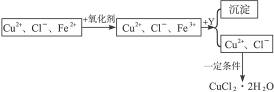
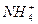 、Cl-、H+、OH-四种离子,下列说法中错误的是( )
、Cl-、H+、OH-四种离子,下列说法中错误的是( )