题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是___;
(2)该反应的平衡常数表达式为K=___;
(3)若知上述反应为放热反应,升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=___。
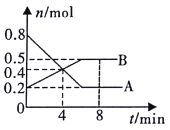
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是___;
图中表示平衡混合物中CO的含量最高的一段时间是___。
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2molN2充分反应,则N2的转化率是___(提示:272=729)
【答案】氮气 K=![]() 减小 6molL-1min-1 升高温度或增大压强 t3~t4 50%
减小 6molL-1min-1 升高温度或增大压强 t3~t4 50%
【解析】
对于反应3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)C由0价升高到+2价,N由0价降低到-3价,由此可确定该反应的氧化剂。
(2)该反应的平衡常数表达式为生成物中气体的浓度幂除以反应物中气体的浓度幂。
(3)若知上述反应为放热反应,升高温度,平衡逆向移动,由此确定其平衡常数值的变化;若已知CO生成速率为v(CO)=18mol·L-1·min-1,则由化学计量数关系,确定N2消耗速率。
(4)图中t4时,V正、V逆都突然增大,说明是增大压强或升高温度所致,再分析反应,便可确定引起平衡移动的条件。
图中表示平衡混合物中CO的含量最高的一段时间,应为最后出现平衡正向移动的平衡点。
(5)利用三段式,确定气体的平衡量,得出平衡常数的计算式,从而求出N2的变化量,最后求出N2的转化率。
对于反应3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)C由0价升高到+2价,N由0价降低到-3价,由此可确定该反应的氧化剂为氮气。答案为:氮气;
(2)该反应的平衡常数表达式为K=![]() 。答案为:K=
。答案为:K=![]() ;
;
(3)若知上述反应为放热反应,升高温度,平衡逆向移动,由此确定其平衡常数值减小;若已知CO生成速率为v(CO)=18mol·L-1·min-1,则由化学计量数关系,确定N2消耗速率v(N2)=![]() v(CO)=6mol·L-1·min-1。答案为:减小;6molL-1min-1;
v(CO)=6mol·L-1·min-1。答案为:减小;6molL-1min-1;
(4)图中t4时,V正、V逆都突然增大,说明是增大压强或升高温度所致,该反应为放热的体积增大的可逆反应,不管是升高温度还是增大压强,平衡都是逆向移动,V逆>V正,所以,图中t4时引起平衡移动的条件可能是升高温度或增大压强。答案为:升高温度或增大压强;
图中,t2~t3段,平衡正向移动,平衡混合物中CO的含量增大;t4~t5,平衡逆向移动,平衡混合物中CO的含量减小,所以,图中表示平衡混合物中CO的含量最高的一段时间是t3~t4。答案为:t3~t4;
(5)设N2的物质的量的变化量为x
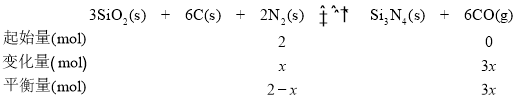
K=![]() =
=![]() =729=272,则
=729=272,则![]() ,从而求出x=1。
,从而求出x=1。
则N2的转化率是![]() =50%。答案为:50%。
=50%。答案为:50%。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
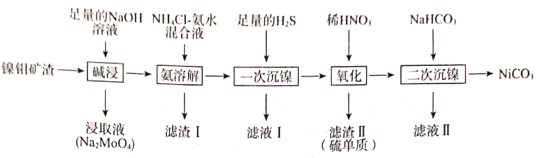
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
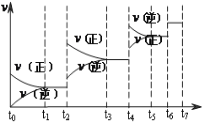
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
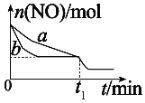
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2