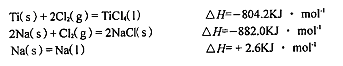题目内容
(8分)(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,该反应的化学方程式是_____________________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知:H2O(l)
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式______________________。
②则16 g液态肼与足量过氧化氢反应生成液态水时放出的热量是___________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知:H2O(l)
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式______________________。
②则16 g液态肼与足量过氧化氢反应生成液态水时放出的热量是___________________。
(1)2NH3+NaClO=N2H4+NaCl+H2O
(2)①2H4(l)+2H2O2(l)=N2(g)+4H2O(l) H=-817.625kJ/mol
②08.8125kJ
(2)①2H4(l)+2H2O2(l)=N2(g)+4H2O(l) H=-817.625kJ/mol
②08.8125kJ
试题分析:这道题考查的是有关热化学反应中的一些知识,在反应中涉及到氧化还原反应的有关知识,在反应中得失电子相等,所以:(1)2NH3+NaClO=N2H4+NaCl+H2O;在第二个问题中,要求写出生成液态中的时候的热化学方程式,12.8g的肼的物质的量为0.4mol,所以有N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) H=-817.625kJ/mol

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
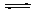 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 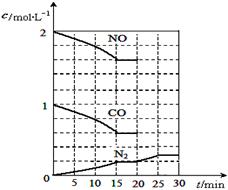
 CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。 CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1


 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1