题目内容
【题目】硫酸厂的烧渣主要成分是Fe2O3,其次含少量的SiO2和FeS。工业上利用硫酸厂烧渣经回收处理制得绿矾(FeSO4·7H2O)和一种聚铁胶体[Fe(OH)SO4]n。绿矾是治疗缺铁性贫血药品的重要成分,而聚铁胶体是重要的水处理剂。上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是_______________:
A.用氨水吸收 B. 直接用水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(2)操作Ⅲ是_____________、_______________、过滤、洗涤、干燥保存等;
(3)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是___________________。
(4)在反应釜中FeS、O2及稀H2SO4反应硫酸铁等物质,则反应的离子方程式为___________________________;
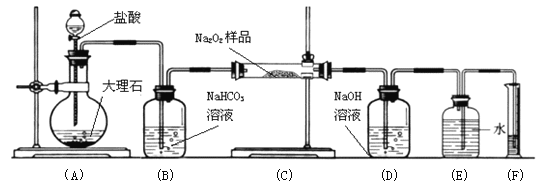
(5)某研究性小组为探究绿矾(相对分子质量:278)在隔绝空气条件下加热分解反应的产物(已知分解产物全为氧化物),进行了如图所示的实验:

① 实验开始时,在点燃C处酒精喷灯之前应先打开活塞通CO2,其目的是_____________。 装置D的作用是______________________。
②该组同学设计的装置存在着一个明显的缺陷是____________________________。
③该组同学称取55.6 g绿矾按上图装置进行实验。待绿矾分解完全后,E瓶中产生了23.3 g白色沉淀。将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色;另取少量该溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色。据写出绿矾分解的化学方程式为__________________________。
【答案】(1)AD;(2)蒸发浓缩,冷却结晶;
(3)促使Fe3+充分水解并形成聚铁胶体;
(4)4FeS+3O2+12H+=4Fe3++4S↓+6H2O;
(5)①排尽装置内的空气;防倒吸(或作安全瓶);
②没有尾气处理装置;③2(FeSO4·7H2O)![]() Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。
【解析】
试题分析:(1)灼烧产生的气体为SO2,SO2是引起酸雨的主要原因, SO2是酸性氧化物,常采用氨水或与石灰石吸收,故选项AD正确;(2)得到晶体,常采用蒸发浓缩、冷却结晶;(3)调节pH的目的是:促使Fe3+充分水解并形成聚铁胶体;(4)根据信息以及流程图,FeS+O2+H2SO4→Fe2(SO4)+S+H2O,Fe元素的化合价由+2价→+3价,化合价升高1价,S的价态由-2价→0价,化合价升高2价,共升高3价,O2中O的化合价由0价→-2价,共降低4价,最小公倍数是12,因此离子反应方程式为:4FeS+ 3O2 + 12H+=4Fe3++ 4S↓+6H2O;(5)①通CO2的目的是排除装置的空气,防止Fe2+被氧气氧化成Fe3+,装置D的作用是起安全瓶的作用;②缺少尾气的处理的装置;③E瓶中沉淀是BaSO4,说明C中产生SO3,即物质的量为n(BaSO4)=n(SO3)=23.3/233mol=0.1mol,将C中固体产物投入足量稀硫酸中完全溶解得到溶液,取少量该溶液滴入KSCN溶液呈红色,推出溶液含有Fe3+,溶液滴入酸性KMnO4溶液,KMnO4溶液不褪色,说明溶液中不含Fe2+,n(FeSO4·7H2O)=55.6/278mol=0.2mol,根据硫元素守恒,因此灼烧后有SO2,且物质的量为0.1mol,因此反应方程式为:2(FeSO4·7H2O) ![]() Fe2O3+SO2↑+SO3↑+14H2O。
Fe2O3+SO2↑+SO3↑+14H2O。