题目内容
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
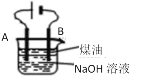
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
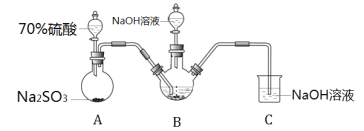
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
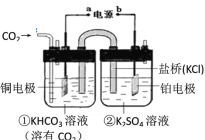
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)
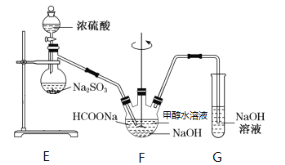
第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
【答案】悬浊液 2SO2 +Zn=ZnS2O4 Zn(OH)2 Na2S2O4(s)![]() 2Na+(aq)+S2O42-(aq),加入固体NaCl,增大Na+浓度,平衡右移,促进Na2S2O4析出 NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O 7 甲酸钠法工艺操作简单;锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低;锌粉法废液中锌离子对环境有较大污染,甲酸钠法没有废液产生
2Na+(aq)+S2O42-(aq),加入固体NaCl,增大Na+浓度,平衡右移,促进Na2S2O4析出 NaOH+HCOONa+2SO2=Na2S2O4+CO2+H2O 7 甲酸钠法工艺操作简单;锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低;锌粉法废液中锌离子对环境有较大污染,甲酸钠法没有废液产生
【解析】
(1)分散系中分散质的粒径大于100纳米时为浊液,180m>100nm,所以该分散系为悬浊液;装置B中的反应物为Zn,SO2,生成物为ZnS2O4,S2O42-中硫为+3价,根据电子守恒和元素守恒可得反应方程式为:![]() ,故答案为:悬浊液;
,故答案为:悬浊液;![]() ;
;
(2)溶液中含有Zn2+,加入氢氧化钠后与氢氧根反应生成氢氧化锌沉淀,故答案为:Zn(OH)2;
(3)生成Na2S2O4晶体时![]() ,加入加入固体NaCl,增大Na+浓度,平衡右移,促进Na2S2O4析出;
,加入加入固体NaCl,增大Na+浓度,平衡右移,促进Na2S2O4析出;
(4)装置F中的反应物有SO2、NaOH和HCOONa, S2O42-中硫为+3价,故SO2做氧化剂,还原剂为HCOONa,结合电子守恒和元素守恒可得方程式为:![]() ;
;
(5)H2SO3的电离常数为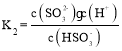 ,当HSO3-、SO32-离子浓度相等时,即
,当HSO3-、SO32-离子浓度相等时,即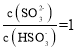 时,氢离子浓度等于K2≈1.0×10-7,pH值约为7,故答案为:7;
时,氢离子浓度等于K2≈1.0×10-7,pH值约为7,故答案为:7;
(6)方案优点一般从成本,操作复杂性,环保,安全、原料利用率等角度回答,故答案为:甲酸钠法工艺操作简单;锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低;锌粉法废液中锌离子对环境有较大污染,甲酸钠法没有废液产生。