��Ŀ����
����Ŀ��Ѫ�����к���C��O��N��Fe����Ԫ�أ��ش��������⣺
��1��C��N��O����Ԫ���е縺����С���� �� ����Ԫ�ط��ţ���д����̬Feԭ�ӵĺ�������Ų�ʽ����д�� ��
��2����ͼ1��ʾΪѪ�쵰�ͼ��쵰�Ļ��Բ��֩���Ѫ���صĽṹʽ��Ѫ������Nԭ�ӵ��ӻ���ʽ�� �� ����ͼ2�ķ������á��������Fe2+����λ���� 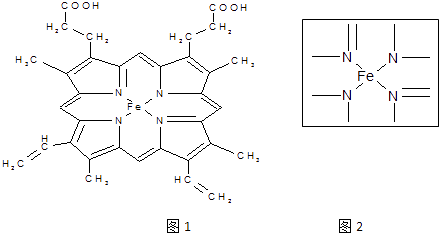
��3��NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiOFeO ���������������
��4�����ݵȵ���ԭ����д��CN���ĵ���ʽ �� 1mol O22+�к��еĦм���ĿΪ ��
��5�����Цġ��á�������ͬ�������壬�þ��徧���������е���ԭ����Ϊ �� �ġ������־�������ԭ�ӵ���λ��֮��Ϊ �� 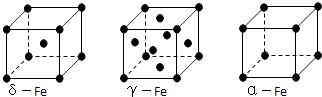
��6������������ɽ�ΪTiCl3.6H2O�ľ��壬���� Ti3+����λ����Ϊ6����һ��Ϊ��ɫ��
��һ��Ϊ��ɫ��Ϊ�ⶨ�����־���Ļ�ѧʽ������ʵ�飺
����������ᄃ���ȡ1mol��ɴ�����Һ��
�ڷֱ���������Һ�е���AgNO3��Һ����������ɫ������
�۳�����ȫ��ֱ���ˡ�ϴ�ӡ���������������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ����Ϊ3mol����ɫ�����ˮ��Һ��Ӧ�õ��İ�ɫ����Ϊ2mol������ɫ����Ļ�ѧʽΪ ��
���𰸡�
��1��C��[Ar]3d64S2
��2��sp2��sp3
��3����
��4��![]() ��2NA
��2NA
��5��4��4��3
��6��[TiCl��H2O��5]Cl2?H2O
���������⣺��1.��ͬ����Ԫ�ش�����Ԫ�صĵ縺�����������е縺��C��N��O��C�ĵ縺����С����̬Feԭ�ӵĺ���۵����Ų�ʽΪ��[Ar]3d64S2 �� �ʴ��ǣ�C��[Ar]3d64S2��
��2.������Nԭ�ӵļ۵����Ų�ʽ2s22p3 �� ��Nԭ���γ�3�����ۼ�����ԭ����Χ����һ�Թ¶Ե��ӣ�����ʱ����λ�����õ�ԭ��Ϊsp3�ӻ�����NH3 �� ��Nԭ���γ�4�����ۼ��������һ������λ������������˫����˫����Ϊ����������õ�ԭ��Ϊsp2�ӻ����籾���е�  ������Ϊ��������õ�ԭ��Ϊsp3�ӻ�����NH4+ �� ���Դ��ǣ�sp2��sp3��
������Ϊ��������õ�ԭ��Ϊsp3�ӻ�����NH4+ �� ���Դ��ǣ�sp2��sp3��  ��
��
��3.��Ni0��Fe0�ľ���ṹ���;����Ȼ��Ƶ���ͬ��˵�����߶������Ӿ��壬���Ӿ�����۵������Ӽ���ǿ���йأ��������������Խ�࣬���Ӱ뾶ԽС�����Ӽ�Խǿ���۵�Խ�ߣ�����Ni2+�����Ӱ뾶С��Fe2+�����Ӱ뾶�������۵���NiO��FeO�����Դ��ǣ�����
��4.��N2��CN��Ϊ�ȵ����壬������������ͨ�����õ��Ӷ��γɹ��ۼ�����ԭ�Ӻ�����5�����ӣ��γɵ��������������ӵĵ���ʽΪ ![]() �����ݵ������ӵĵ���ʽд��CN���ĵ���ʽ����CN�������ӣ����������ʽΪ��
�����ݵ������ӵĵ���ʽд��CN���ĵ���ʽ����CN�������ӣ����������ʽΪ�� ![]() �����ݵȵ�����ԭ����֪��O22+�ĵ���ʽ
�����ݵȵ�����ԭ����֪��O22+�ĵ���ʽ ![]() ����1mol��������2mol�Ħм���1mol�Ħļ�����1mol O22+�У�����2NA���м����ʴ��ǣ�
����1mol��������2mol�Ħм���1mol�Ħļ�����1mol O22+�У�����2NA���м����ʴ��ǣ� ![]() ��2NA��
��2NA��
��5.���þ��徧���������е���ԭ����Ϊ8�� ![]() +6��
+6�� ![]() =4���ġ������־�������ԭ�ӵ���λ���ֱ�Ϊ8��6������λ��֮��Ϊ8��6=4��3�����Դ��ǣ�4�� 4��3��
=4���ġ������־�������ԭ�ӵ���λ���ֱ�Ϊ8��6������λ��֮��Ϊ8��6=4��3�����Դ��ǣ�4�� 4��3��
��6.�������ӿ����������ӷ�Ӧ�����Ȼ�����ɫ������ͨ�����������������ƶϳ������ӵĺ���������ԭ��ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ����Ϊ3mol����ɫ�����ˮ��Һ��Ӧ�õ��İ�ɫ����Ϊ2mol�����־������ɽ�ΪTiCl36H2O��˵����ɫ�����������������ƶ��������ӣ�����ɫ������ֻ��2�������ƶ������ӣ�����һ����ԭ���γ���������Ϊ��Ϊ6��λ������������������ˮ������ѧʽΪ[TiCl��H2O��5]Cl2H2O������ɫ����Ļ�ѧʽΪ[Ti��H2O��6]Cl3 �� ���Դ��ǣ�[TiCl��H2O��5]Cl2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�