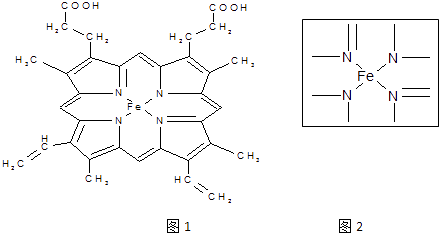
题目内容
【题目】根据已学知识,请你回答下列问题:
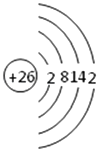
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
【答案】
(1)
(2)Si或S
(3)硒
(4)﹣892KJ/mol
(5)sp2;sp3;V形;三角锥型
(6)F﹣H…F;F﹣H…O;O﹣F…F;O﹣H…O
【解析】解:(1.)第Ⅷ族元素有铁、钴、镍,原子序数最小的是铁,原子核外有26个电子,其原子结构示意图为:  ,所以答案是:
,所以答案是: 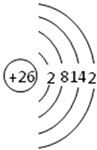 ;
;
(2.)3p轨道上有2个未成对电子时有两种情况,一种是另一个3p轨道上没有电子,一种是另一个3p轨道上充满电子,所以当另一个3p轨道上没有电子,该原子是Si;一种是另一个3p轨道上充满电子,该原子是S,所以答案是:Si或S;
(3.)原子的外围电子排布是4s24p4 , 说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,所以答案是:硒;
(4.)△H=反应物的键能和﹣生成物的键能和=2×175KJ/mol+498KJ/mol﹣4×460KJ/mol=﹣892KJ/mol,所以答案是:﹣892KJ/mol;
(5.)二氧化硫分子是O原子价层电子对2+ ![]() (6﹣2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+
(6﹣2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+ ![]() (6﹣2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
(6﹣2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+ ![]() (6﹣1﹣3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,所以答案是:sp2;sp3;V形;三角锥型;
(6﹣1﹣3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,所以答案是:sp2;sp3;V形;三角锥型;
(6.)N、O、F和氢原子之间能形成氢键,F的氢化物溶液剂为氢氟酸的水溶液,含有HF分子以及H2O分子,存在的所有氢键为F﹣H…F、F﹣H…O、O﹣F…F、O﹣H…O,所以答案是:F﹣H…F、F﹣H…O、O﹣F…F、O﹣H…O.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。