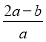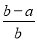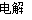题目内容
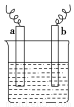
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-=2H2O (4)49g 6.02×1023
【解析】题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-+4OH-=4H2O。(4)n(H2)=0.5 mol,2H++2e-=H2↑,得电子为1 mol,X极的反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。

化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
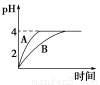
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。