题目内容
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
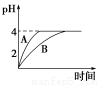
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
(1)B < (2)5 6 (3)向溶液中加入足量BaCl2(或CaCl2)溶液,如果无白色沉淀生成说明甲正确,有白色沉淀产生说明乙正确
【解析】(1)醋酸溶液中存在CH3COOH CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=
CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)= ,c(OH-)=10-9 mol·L-1;c02(OH-)=
,c(OH-)=10-9 mol·L-1;c02(OH-)= mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。
mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。