题目内容
【题目】按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________。
(3)已知CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=_____________________。
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为____________________________。
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为________________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗标准状况下的CO 的体积为224 mL,则溶液的pH = ___________ 。(不考虑溶液体积的变化)

【答案】稀盐酸 Al3++3H2O![]() Al(OH)3+3H+ < 10:1 C(Na+)>C(CO32-)> C(OH-)> C(HCO3-)> C(H+) CO - 2e–+4OH– = CO32-+ 2H2O 13
Al(OH)3+3H+ < 10:1 C(Na+)>C(CO32-)> C(OH-)> C(HCO3-)> C(H+) CO - 2e–+4OH– = CO32-+ 2H2O 13
【解析】
根据盐类水解的规律分析配制氯化铁溶液时加入的试剂和氯化铝的净水原理。根据浓度商和平衡常数的关系分析反应进行的方向。根据物质的量的比例分析氢氧化钠和二氧化碳反应的产物和溶液中的离子浓度关系,根据燃料电池中燃料在负极反应分析电极反应,根据电子守恒分析溶液的离子浓度。
(1)铁离子水解溶液显酸性,所以为了防止水解,溶液中加入少量稀盐酸;
(2)氯化铝水解生成氢氧化铝胶体,胶体具有吸附作用,使水净化,离子方程式为:Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(3) 某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,此时浓度商为Qc= 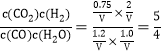 <K,所以平衡应逆向移动,即v正<v逆;
<K,所以平衡应逆向移动,即v正<v逆;
(4)氢氧化钠和盐酸混合后溶液为中性,说明二者恰好完全反应,即氢氧根离子和氢离子物质的量相等,25℃下pH=12的NaOH溶液中氢氧根离子物质的量浓度为0.01mol/L,pH=1的HCl溶液中氢离子物质的量为0.1mol/L,则有0.01×a=0.1×b,则a:b=10:1;
(5)氢氧化钠的物质的量为0.1mol,二氧化碳的物质的量为1.12L÷22.4L/mol==0.05mol,则二者比例为2:1,反应生成碳酸钠,因为碳酸根离子水解溶液显碱性,所以溶液中的离子浓度关系为: C(Na+)>C(CO32-)> C(OH-)> C(HCO3-)> C(H+);
(6).一氧化碳和氧气组成原电池时一氧化碳在负极反应失去电子生成碳酸根离子,电极反应为:CO - 2e–+4OH– = CO32-+ 2H2O,当消耗标况下224mL一氧化碳气体其物质的量为0.224L÷22.4L/mol=0.01mol,失去电子的物质的量为0.02mol,电解饱和食盐水生成氢气和氯气和氢氧化钠,当有0.02mol电子转移时生成0.02mol氢氧化钠,则氢氧根离子物质的量浓度为0.02mol÷0.2L=0.1mol/L,溶液的pH为13。




