题目内容
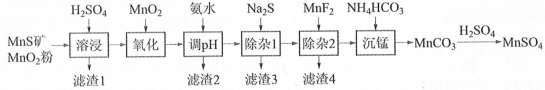
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 molL1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)写出“沉锰”的离子方程式_____________。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=__________。
时,z=__________。
【答案】SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O ![]()
【解析】
二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)与硫酸反应,二氧化锰粉与硫化锰矿和硫酸发生氧化还原反应,SiO2不与H2SO4反应或SiO2与其他物质反应生成硅酸盐,加入MnO2氧化Fe2+,以便加入氨水时除掉铁元素,调节溶液pH值大于4.7小于6主要除掉铁元素和铝元素,除杂1主要除掉Zn2+和Ni2+,除杂2主要除掉Mg2+,得到Mn2+,加入碳酸氢铵溶液沉锰生成碳酸锰,加入硫酸生成硫酸锰。
(1)SiO2不与H2SO4反应或SiO2与其他物质反应生成硅酸盐,MnO2、MnS和H2SO4反应生成S、H2O和MnSO4,因此“滤渣1”含有S和SiO2;“溶浸”中二氧化锰与硫化锰反应的化学方程式MnO2+MnS+2H2SO4= 2MnSO4 + S + 2H2O;故答案为:SiO2(不溶性硅酸盐);MnO2+ MnS+2H2SO4=2MnSO4+S+2H2O。
(2)根据Mn2+、Fe2+的开始沉淀的pH值可知应将Fe2+氧化为Fe3+,避免除铁元素时沉淀锰,因此“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+。
(3)“调pH”除铁和铝,应将pH控制在大于它们各种离子沉淀完全时的pH值以上,因此溶液的pH范围应调节为4.7~6之间;故答案为:4.7。
(4)“沉锰”是Mn2+与HCO3-反应生成碳酸锰,其离子方程式Mn2++2HCO3-= MnCO3↓ + CO2↑+H2O;故答案为:Mn2++2HCO3-= MnCO3↓ + CO2↑+H2O。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x= y =![]() 时,根据化合价代数和为0得出
时,根据化合价代数和为0得出![]() ,则z=
,则z=![]() ;故答案为:
;故答案为:![]() 。
。