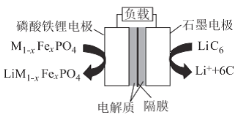
题目内容
【题目】(1)配平下列方程式
①_____Na+_____H2O =_____NaOH+_____H2↑
②_____Na2O2 +_____ CO2=_____ NaCO3 +_____O2↑
③_____KMnO4 +_____HCl(浓) =_____ KCl +_____MnCl2 +_____H2O + _____Cl2↑
④_____Al+_____H2O +_____NaOH =_____Na AlO2 +_____H2↑
(2)用双线桥法表示电子转移的数目和方向____________、__________
①2Na2O2 + 2H2O = 4NaOH + O2↑
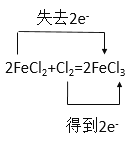
②2FeCl2 + Cl2 = 2FeCl3
【答案】2 2 2 1 2 2 2 1 2 16 2 2 8 5 2 2 2 2 3 
【解析】
配平氧化还原方程时先判断氧化剂、还原剂、氧化产物、还原产物,可利用化合价升降守恒来配平,再通过原子守恒来配平其他物质。
(1) ① Na由0价变为+1价,H由+1价变为0价,故方程为:![]() ,故答案为:2;2;2;1;
,故答案为:2;2;2;1;
②此为歧化反应,O化合价由-1价变为-2价和0价,故方程为:![]() ,故答案为:2;2;2;1;
,故答案为:2;2;2;1;
③Mn化合价由+7价下降为+2价,Cl化合价由-1价升高为0价,故方程为:![]() ,故答案为:2;16;2;2;8;5;
,故答案为:2;16;2;2;8;5;
④Al化合价由0价升高为+3价,H化合价有+1价下降为0价,故方程为:![]() ,故答案为:2;2;2;2;3;
,故答案为:2;2;2;2;3;
(2)①此化学方程式为歧化反应,O由+1价变为-2价和0价,双线桥表示为: ,故答案为:
,故答案为:
②Fe2+离子为还原剂化合价由+2变为+3价失去一个电子,Cl由0价变为-1价得到一个电子,用双线桥表示为: ,故答案为:
,故答案为: 。
。

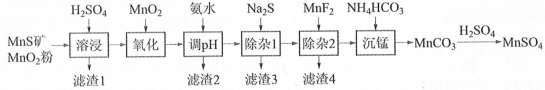
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 molL1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)写出“沉锰”的离子方程式_____________。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=__________。
时,z=__________。