题目内容
15.将0.1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是( )| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{+})}$ | B. | c(OH-) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | c(NH4+) |
分析 将0.1mol/L的氨水稀释10倍,溶液中随着水量的增加,由NH3.H2O?OH-+NH4+可知,n(OH-)、n(NH4+)增大,但溶液的体积增大的多,则c(OH-)、c(NH4+)都减小,加水会促进电离,则n(NH3.H2O)减少,据此进行判断.
解答 解:由NH3.H2O?OH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大,故A错误、C正确;
加水稀释过程中,溶液中氢氧根离子、铵根离子的浓度都会减小,故B、D错误;
故选C.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
5.下列有关化学用语正确的是( )
| A. | Na+的基态电子排布图是: | |
| B. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1NA | |
| C. | Na2S的电子式: | |
| D. | 氯离子结构示意图为: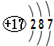 |
6.下列物质属于等电子体一组的是( )
| A. | CH3Cl和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、NO2 | D. | H2O和CH4 |
3.将8g Al和Mg合金投入足量的盐酸中,经充分反应收集到标准状况下H2的体积4.48L,向反应后的溶液中加入足量的氨水溶液,经过滤干燥得到沉淀mg,m的值是( )
| A. | 10.4 | B. | 14.8 | C. | 13.6 | D. | 15.8 |
10.下列各组物质中,既不是同系物,又不是同分异构体的是( )
| A. | 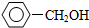 和 和 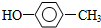 | B. | 苯甲酸和 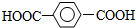 | ||
| C. | 乙酸和硬脂酸 | D. | 硝基乙烷和氨基乙酸 |
7.下列说法中不正确的是( )
| A. | 冰醋酸、酒精、氨气、苯等均是非电解质 | |
| B. | 石油经分馏得到的各种馏分仍然是混合物 | |
| C. | 胶体区别于其他分散系的本质特征是分散质粒子的直径不同 | |
| D. | 玻璃、水泥和陶瓷的主要成分都属于硅酸盐 |
4.近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示: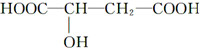
下列相关说法正确的是( )
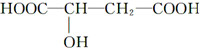
下列相关说法正确的是( )
| A. | 1mol苹果酸在一定条件下能与足量钠反应生成3mol氢气 | |
| B. | 苹果酸在一定条件下能催化氧化生成醛 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与NaHCO3溶液反应最多消耗2 mol NaHCO3 |
5.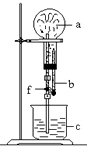 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
 在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶.则a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO | NaOH溶液 |
| B | Cl2 | 饱和NaCl溶液 |
| C | CO2 | KOH溶液 |
| D | NO2 | 水溶液 |
| A. | A | B. | B | C. | C | D. | D |
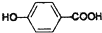
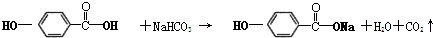 ,
,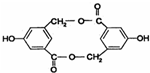 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.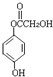 等(只写一种).
等(只写一种).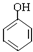 .
.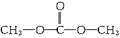 .
.