题目内容
3.将8g Al和Mg合金投入足量的盐酸中,经充分反应收集到标准状况下H2的体积4.48L,向反应后的溶液中加入足量的氨水溶液,经过滤干燥得到沉淀mg,m的值是( )| A. | 10.4 | B. | 14.8 | C. | 13.6 | D. | 15.8 |
分析 Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子守恒计算合金失去电子量,从而确定n(OH-),据此分析解答.
解答 解:n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,Mg、Al合金分别和足量稀盐酸反应生成氯化物和氢气,氯化镁、氯化铝和足量氨水反应分别生成Mg(OH)2、Al(OH)3沉淀,所以最后得到的沉淀是氢氧化镁和氢氧化铝的混合物,一个电子带一个单位负电荷、一个氢氧根离子带一个单位负电荷,所以镁铝合金失去电子物质的量与生成氢氧化物需要氢氧根离子的物质的量相等,根据转移电子相等知,镁铝失电子物质的量=0.2mol×2=0.4mol,则沉淀中n(OH-)=0.4mol,沉淀质量m=m(合金)+m(OH-)=8g+0.4mol×17g/mol=14.8g,故选B.
点评 本题考查混合物的计算,为高频考点,侧重考查学生分析计算能力,明确OH-与转移电子关系是解本题关键,注意解题方法、技巧,题目难度不大.

练习册系列答案
相关题目
13.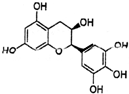 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子式为C15H13O7 | |
| B. | EGC可在强碱的醇溶液中发生消去反应 | |
| C. | 1molEGC最多消耗6molNaOH | |
| D. | 1molEGC加入溴水中,可与4molBr2发生取代反应 |
11.金属钾晶体(如图)的结构的叙述中正确的是( )
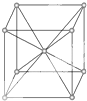

| A. | 是密置层的一种堆积方式 | B. | 晶胞是六棱柱 | ||
| C. | 每个晶胞内含2个原子 | D. | 每个晶胞内含6个原子 |
18.下列化合物的1H-NMR谱图中吸收峰的数目不正确的是( )
| A. | 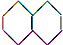 (2组) | B. | 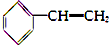 (5组) | C. | 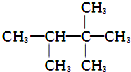 (3组) (3组) | D. | 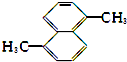 (4组) (4组) |
8.向1mo1酒石酸[HOOC(CHOH)2COOH]中加入1mol•L-1KOH溶液1L时,得最大沉淀量,再向其中加入1L上述KOH溶液时,沉淀完全溶解,下列有关叙述中,错误的是( )
| A. | 酒石酸是有机二元酸 | B. | 酒石酸与铝盐性质相似 | ||
| C. | 酒石酸氢钾的溶解度小 | D. | 酒石酸钾的溶解度大 |
15.将0.1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{+})}$ | B. | c(OH-) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | c(NH4+) |
12.下列离子方程式正确的是( )
| A. | 苯酚钠中通二氧化碳反应:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| B. | 电解饱和食盐水:2H++2Cl?$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | Na2CO3溶液显碱性:CO32-+H2O═HCO3-+OH- | |
| D. | 足量AlCl3溶液与纯碱溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
13.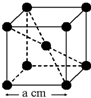 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
 已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )
已知某晶体的密度为ρ g•cm3,NA为阿伏加德罗常数,晶胞边长为a cm(如图),则该晶体的相对分子质量可表示为( )| A. | NA•a3•ρ | B. | $\frac{{N}_{A}•{a}^{3}•ρ}{6}$ | C. | $\frac{{N}_{A}•{a}^{3}•ρ}{4}$ | D. | $\frac{{N}_{A}•{a}^{3}•ρ}{2}$ |