题目内容
6.下列物质属于等电子体一组的是( )| A. | CH3Cl和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、NO2 | D. | H2O和CH4 |
分析 原子数相同、价电子总数相同的分子,互称为等电子体由此来解答.
解答 解:A、CH3Cl中价电子数为14,NH4+中价电子数为10,两者价电子数不相同,故A错误;
B、B3H6N3和C6H6原子数相同、价电子总数都是30,所以互称为等电子体,故B正确;
C、CO2中价电子数为16,NO2中价电子数为17,所以两者价电子数不同,故C错误;
D、H2O和CH4原子数不相同,故D错误;
故选B.
点评 本题考查等电子体的概念,抓住两个相等即可解题,比较简单.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
16.将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应:
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
①2N2O5(g)?2N2O4(g)+O2(g);②N2O4(g)?2NO2(g).达到平衡时,c(O2)=0.2mol•L-1,c(NO2)=0.6mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 3.2 | B. | 0.2 | C. | $\frac{1}{180}$ | D. | $\frac{4}{45}$ |
17.依据下表所列实验及现象得出的结论不正确的是( )
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪色为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |
11.金属钾晶体(如图)的结构的叙述中正确的是( )
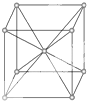

| A. | 是密置层的一种堆积方式 | B. | 晶胞是六棱柱 | ||
| C. | 每个晶胞内含2个原子 | D. | 每个晶胞内含6个原子 |
18.下列化合物的1H-NMR谱图中吸收峰的数目不正确的是( )
| A. | 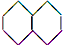 (2组) | B. | 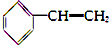 (5组) | C. | 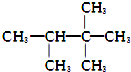 (3组) (3组) | D. | 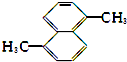 (4组) (4组) |
15.将0.1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{+})}$ | B. | c(OH-) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | c(NH4+) |
 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题: