题目内容
7.下列说法中不正确的是( )| A. | 冰醋酸、酒精、氨气、苯等均是非电解质 | |
| B. | 石油经分馏得到的各种馏分仍然是混合物 | |
| C. | 胶体区别于其他分散系的本质特征是分散质粒子的直径不同 | |
| D. | 玻璃、水泥和陶瓷的主要成分都属于硅酸盐 |
分析 A、水溶液中和熔融状态下都不能导电的化合物称为非电解质;
B、混合物是指由多种物质组成的物质;
C、胶体微粒直径在1-100nm之间;
D、硅酸盐工业是以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得,相应生成物是硅酸盐.含有硅酸根离子的盐属于硅酸盐,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥.
解答 解:A、冰醋酸水溶液中导电属于电解质,酒精、氨气、苯等水溶液中和熔融状态下都不能导电,均是非电解质,故A错误;
B、分馏石油得到的各个馏分为某温度范围内烃类物质的混合物,故B正确;
C、胶体微粒直径在1-100nm之间,溶液中微粒之间<1nm,浊液中微粒之间>100nm,所以胶体区别于其他分散系的本质特征是分散质粒子的直径不同,故C正确;
D、硅酸盐工业是以含硅元素物质为原料通过高温加热发生复杂的物理、化学变化制得,相应生成物是硅酸盐.含有硅酸根离子的盐属于硅酸盐,传统硅酸盐产品包括:普通玻璃、陶瓷、水泥,故D正确;
故选A.
点评 本题考查非电解质和电解质区别,胶体的本质区别,元素化合物知识,侧重于物质的性质与用途的考查,为高频考点,注意硅酸盐产品分析,难度不大.

练习册系列答案
相关题目
17.依据下表所列实验及现象得出的结论不正确的是( )
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C(Vc) | 溶液褪色为浅绿色 |
| Fe(OH)3胶体通直流电 | 阴极附近红褐色加深 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C(Vc)具有还原性 | B. | Fe(OH)3胶体粒子带正电荷 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |
18.下列化合物的1H-NMR谱图中吸收峰的数目不正确的是( )
| A. | 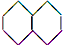 (2组) | B. | 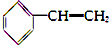 (5组) | C. | 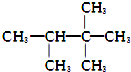 (3组) (3组) | D. | 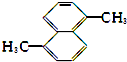 (4组) (4组) |
15.将0.1mol/L的氨水稀释10倍,随着氨水浓度的降低,下列数据逐渐增大的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{+})}$ | B. | c(OH-) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | c(NH4+) |
2.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,30克乙酸与30克葡萄糖含有的氧原子数均为NA | |
| B. | 在标准状况下,11.2L O2和22.4 L NO混合并充分反应后得到的气体分子数为NA | |
| C. | 3.65克液态HCl中含有构成粒子的总数为0.2NA | |
| D. | 常温下,5.6克Fe投入到足量浓硝酸中,转移电子数为0.3NA |
12.下列离子方程式正确的是( )
| A. | 苯酚钠中通二氧化碳反应:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| B. | 电解饱和食盐水:2H++2Cl?$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | Na2CO3溶液显碱性:CO32-+H2O═HCO3-+OH- | |
| D. | 足量AlCl3溶液与纯碱溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
19.下列溶液中,一定能大量共存的微粒组是( )
| A. | pH=1的溶液中:K+、Cr2O72-、CH3CH2OH、SO42- | |
| B. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| D. | 含有较多Al3+的溶液:HCO3-、K+、Na+、Cl- |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液呈碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题: