题目内容
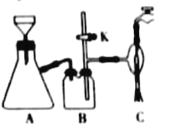
【题目】如图所示是实验室制取SO2并验证SO2某些性质的装置图,试回答:
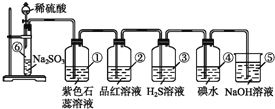
(1)⑥中发生反应的化学方程式为___;
(2)①中实验现象为___,证明SO2是___气体;
(3)②中品红溶液___,证明SO2有___;
(4)③中现象是___,写出SO2与H2O2的化学方程式___;
(5)④中现象是___,证明SO2有___性;
(6)⑤的作用是___,反应的化学方程式为___。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 紫色石蕊溶液变红 酸性 褪色 漂白性 有淡黄色沉淀生成 SO2+H2O2=H2SO4 溶液褪色 溶液褪色 吸收多余的SO2,防止污染空气 2NaOH+SO2=Na2SO3+H2O
【解析】
根据图中反应装置中的反应物的性质书写相关反应方程式;根据实验装置图及实验现象分析二氧化硫的性质,并书写相关反应方程式。
(1)⑥中为亚硫酸钠和稀硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①中为紫色石蕊试液,二氧化硫溶于水和水反应生成亚硫酸,![]() ,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:紫色石蕊溶液变红;酸性;
,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:紫色石蕊溶液变红;酸性;
(3)②中为品红溶液,二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,故答案为:褪色;漂白性;
(4)③中![]() 中
中![]() 价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,所以③中现象是有淡黄色沉淀生成,过氧化氢具有氧化性,
价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,所以③中现象是有淡黄色沉淀生成,过氧化氢具有氧化性,![]() 与
与![]() 反应,二氧化硫具有还原性,两者反应:
反应,二氧化硫具有还原性,两者反应:![]() ,故答案为:有淡黄色沉淀生成;
,故答案为:有淡黄色沉淀生成;![]() ;
;
(5)④中碘水具有氧化性,溶液颜色为紫红色,![]() 中
中![]() 价S具有还原性,两者发生:
价S具有还原性,两者发生:![]() ,溶液褪色,该反应中二氧化硫为还原剂,具有还原性,故答案为:溶液褪色;还原;
,溶液褪色,该反应中二氧化硫为还原剂,具有还原性,故答案为:溶液褪色;还原;
(6)⑤二氧化硫有毒,不能直接排放到空气中,二氧化硫酸性氧化物能够与氢氧化钠反应生成亚硫酸钠和水,所以可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式为:![]() ,故答案为:吸收多余的
,故答案为:吸收多余的![]() ,防止污染空气;
,防止污染空气;![]() 。
。

 名校课堂系列答案
名校课堂系列答案