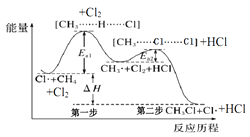
题目内容
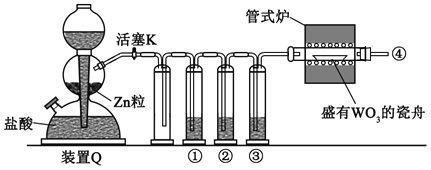
【题目】镍的抗腐蚀性佳,主要用于合金和电镀,也可用作良好的催化剂。现准确称量8g粗镍(含有少量Fe、Cu以及难与酸、碱反应的杂质)进行如下提纯。
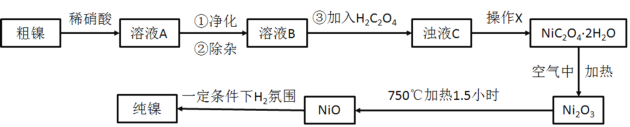
请回答下列问题:
(1)写出稀硝酸溶解镍的离子方程式___。
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,加热过程中补充适量的水保持溶液的体积不变,静止一段时间后,过滤出Fe2O3、FeO(OH)。
①写出煮沸过程中生成FeO(OH)的离子方程式___。
②控制溶液的pH,可利用___。
a.pH试纸 b.石蕊指示剂 c.pH计
③为了得到纯净的溶液B,还需要加入以下物质___(填字母)进行除杂。(已知:Ksp(CuS)=8.8×10-36;Ksp(NiS)=3.2×10-19;Ksp[Cu(OH)2]=2.2×10-20;Ksp[Ni(OH)2]=5.4×10-16)
a.NaOH b.Na2S C.H2S d.NH3·H2O
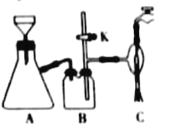
(3)在快速搅拌下缓慢向溶液B中滴加12%的H2C2O4溶液,溶液中即可析出NiC2O4·2H2O,搅拌下煮沸2min冷却。操作X包括:过滤、洗涤和烘干,采用如图的装置进行过滤(备注:该图是一个通过水泵减压过滤的装置)。这种抽滤其优点是___,装置B的主要作用是___,若实验过程中发现倒吸现象,应采取的措施是___。
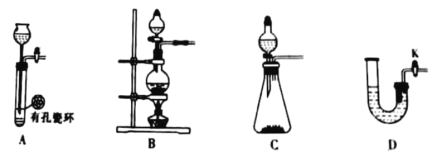
(4)在该生产过程中需要纯净的H2。若实验室要制备纯净的H2,发生装置不可以选择___(选填代号)。
(5)用电子天平称取0.5000g的NiO样品,加入一定体积的6mol/L的盐酸恰好完全溶解,将所得到的溶液配制成250mL的溶液。取出20mL加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为___。(写出表达式即可)
[一定条件下丁二酮肟(![]() ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
【答案】3Ni+8H++2NO3-=3Ni2++2NO+4H2O Fe3++2H2O![]() FeO(OH)↓+3H+ c c 速度快 安全瓶 旋开K B
FeO(OH)↓+3H+ c c 速度快 安全瓶 旋开K B 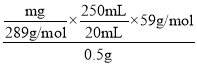 ×100% 生成沉淀质量大,称量误差小,分析结果准确度高
×100% 生成沉淀质量大,称量误差小,分析结果准确度高
【解析】
粗镍与稀硝酸反应,生成镍离子、铁离子、铜离子等,经过净化、除杂,溶液B为硝酸镍溶液,加入H2C2O4生成NiC2O4·2H2O,经过操作X过滤、洗涤和烘干得到NiC2O4·2H2O晶体,在空气中加热生成三氧化二镍,再加热生成NiO,NiO与氢气发生氧化还原反应生成纯镍。
(1)镍与硝酸反应成Ni2+、NO和水,离子方程式为3Ni+8H++2NO3-=3Ni2++2NO+4H2O。
(2)①将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,铁离子水解生成FeO(OH),离子方程式为Fe3++2H2O![]() FeO(OH)↓+3H+。
FeO(OH)↓+3H+。
②实验中要准备测量溶液的pH,只有pH计可以。
③为了得到纯净的溶液B,需要除去Cu2+,又不能减少Ni2+,由溶度积常数可知,CuS的溶解度最小,且远远小于NiS的溶解度,能实现很好的分离,故选择H2S。
(3)由于水流的作用,使漏斗下端的压强小于外界大气压,可以加速过滤的速度;装置B的主要作用是安全瓶;若实验过程中发生倒吸现象,先旋开旋塞K,恢复常压后关闭抽水泵。
(4)实验室制氢气采用锌与稀硫酸反应,不需要加热,装置B为加热制气装置,不符合题意,答案选B。
(5)NiO与盐酸反应生成Ni2+,取250mL中的20mL溶液用丁二酮肟滴定Ni2+发生反Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,得到干燥的固体mg,则Ni(C4N2H7O2)2的质量为mg,其中镍元素的质量为 ![]() ;则0.5g样品中镍元素的质量为
;则0.5g样品中镍元素的质量为![]() ,镍元素的质量分数为
,镍元素的质量分数为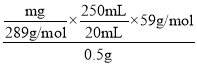 ×100%。
×100%。
Ni2+与丁二酮肟反应生成的沉淀质量大,称量误差小,分析结果准确度高,故选用丁二酮肟有机沉淀剂。

 智能训练练测考系列答案
智能训练练测考系列答案