题目内容
【题目】工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下: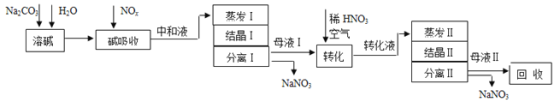
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是________。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
【答案】NaNO3 防止NaNO2的析出 溶碱 将NaNO2氧化为NaNO3 c、d 1.59
【解析】
(1)NO2与碱液反应可生成NaNO3;
(2)浓度过大时,NaNO2可能会析出;NaNO2有毒,不能直接排放,回收后可用于流程中的溶碱;
(3)NaNO2在酸性条件下易被氧化,加入稀硝酸可提供酸性环境;母液Ⅱ的溶质主要是NaNO3,所以回收利用时应转入转化液,或转入结晶Ⅱ操作,故c、d正确;
(4)1.38吨NaNO2的物质的量为:1.38×106÷69g/mol=2×104mol,则生成的NaNO3物质的量为:1×104mol,故Na2CO3的理论用量=![]() ×(2×104+1×104)mol×106g/mol=1.59×106g=1.59吨。
×(2×104+1×104)mol×106g/mol=1.59×106g=1.59吨。

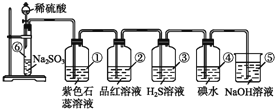
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化