题目内容
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
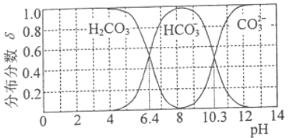
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
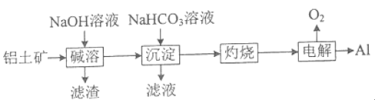
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
【答案】BD 1.4×104 ![]() +H2O
+H2O![]()
![]() +OH- 3.7 B>C>A Fe2O3
+OH- 3.7 B>C>A Fe2O3 ![]() +OH-=
+OH-=![]() +H2O
+H2O ![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]()
【解析】
(1)依据盐类水解规律、电荷守恒和物料守恒分析可得;
(2)当两种沉淀共存时,溶液中硫酸根和碳酸根的浓度之比等于硫酸钙和碳酸钙的溶度积之比;
(3)当c(H2CO3)=c( )时,一级电离平衡常数等于溶液中氢离子浓度,当c(
)时,一级电离平衡常数等于溶液中氢离子浓度,当c(![]() )= c(
)= c(![]() )时,二级电离平衡常数等于溶液中氢离子浓度,碳酸根的水解平衡常数等于水的离子积常数除以二级电离平衡常数,通过比较电离平衡常数的大小,判断盐的水解程度大小;
)时,二级电离平衡常数等于溶液中氢离子浓度,碳酸根的水解平衡常数等于水的离子积常数除以二级电离平衡常数,通过比较电离平衡常数的大小,判断盐的水解程度大小;
(4)由流程可知,向铝土矿中加入氢氧化钠溶液,两性氧化物氧化铝和酸性氧化物能与氢氧化钠溶液反应,碱性氧化物氧化铁与氢氧化钠溶液不反应,其中二氧化硅转化为铝硅酸钠沉淀,氧化铝转化为偏铝酸钠溶液,过滤得到偏铝酸钠和氢氧化钠的混合溶液;向混合溶液中加入碳酸氢钠溶液,碳酸氢钠溶液先与氢氧化钠溶液反应,再与偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸钠,过滤得到氢氧化铝沉淀;灼烧氢氧化铝,氢氧化铝分解生成氧化铝,电解熔融的氧化铝制得金属铝。
(1)A.0.1mol·L-1的Na2CO3溶液中存在电荷守恒关系c(Na+)+ c(H+) =c(OH-)+c(![]() )+2c(
)+2c(![]() ),故错误;
),故错误;
B.0.1mol·L-1的NaHCO3溶液中存在物料守恒关系 c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3),故正确;
)+ c(H2CO3),故正确;
C.0.1mol·L-1的NaHCO3溶液中,![]() 的水解程度大于电离程度,溶液呈碱性,则c(H2CO3)> c(
的水解程度大于电离程度,溶液呈碱性,则c(H2CO3)> c(![]() ),故错误;
),故错误;
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液中电荷守恒关系c(Na+)+c(H+) =c(OH-)+c(![]() )+2c(
)+2c(![]() ),还存在物料守恒关系2c(Na+) =3c(
),还存在物料守恒关系2c(Na+) =3c(![]() ) +3 c(
) +3 c(![]() )+ 3c(H2CO3),整合电荷守恒关系和物料守恒关系可得2c(H+)+c(
)+ 3c(H2CO3),整合电荷守恒关系和物料守恒关系可得2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() ),故正确;
),故正确;
故答案为:BD;
(2)当两种沉淀共存时, 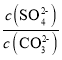 =
=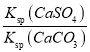 =
=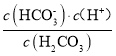 =
=![]() =1.4×104,故答案为:1.4×104;
=1.4×104,故答案为:1.4×104;
(3)碳酸的一级电离平衡常数Ka1=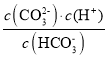 ,由图可知pH=6.4时,c(H2CO3)=c(
,由图可知pH=6.4时,c(H2CO3)=c( ),Ka1=1.0×10-6.4,二级电离平衡常数Ka2=
),Ka1=1.0×10-6.4,二级电离平衡常数Ka2=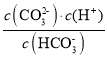 ,由图可知pH=10.3时,c(
,由图可知pH=10.3时,c(![]() )= c(
)= c(![]() ),则Ka2=1.0×10-10.3;
),则Ka2=1.0×10-10.3;
①碳酸钠是强碱弱酸盐,![]() 在溶液中水解使溶液呈碱性,碱性条件下,油脂水解达到除油污的目的,碳酸是二元弱酸,碳酸根在溶液中分步水解,以一级水解为主,则水解的离子方程式为
在溶液中水解使溶液呈碱性,碱性条件下,油脂水解达到除油污的目的,碳酸是二元弱酸,碳酸根在溶液中分步水解,以一级水解为主,则水解的离子方程式为![]() +H2O
+H2O![]()
![]() +OH-,25℃时,该反应的平衡常数表示为Kh=
+OH-,25℃时,该反应的平衡常数表示为Kh=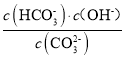 =
=![]() =
=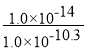 =1.0×10-3.7,则pKh=3.7,故答案为:
=1.0×10-3.7,则pKh=3.7,故答案为:![]() +H2O
+H2O![]()
![]() +OH-;3.7;
+OH-;3.7;
②酸越强,电离平衡常数越大,由电离平衡常数可知,电离程度H2CO3>HCN>![]() ,酸的电离程度越大,对应盐的水解程度越小,水解程度
,酸的电离程度越大,对应盐的水解程度越小,水解程度![]() >CN—>
>CN—>![]() ,则浓度均为.0.1mol·L-1的NaHCO3溶液、Na2CO3溶液和NaCN溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>NaHCO3溶液,故答案为:B>C>A;
,则浓度均为.0.1mol·L-1的NaHCO3溶液、Na2CO3溶液和NaCN溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>NaHCO3溶液,故答案为:B>C>A;
(4)①由分析可知,滤渣中除含铝硅酸钠外,还含有氧化铁,故答案为:Fe2O3;
②“沉淀”步骤时,碳酸氢钠溶液先与氢氧化钠溶液反应,再与偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸钠,反应的离子方程式分别为![]() +OH-=
+OH-=![]() +H2O和
+H2O和![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]() ,故答案为:
,故答案为:![]() +OH-=
+OH-=![]() +H2O;
+H2O;![]() +
+![]() +H2O=Al(OH)3↓+
+H2O=Al(OH)3↓+![]() 。
。