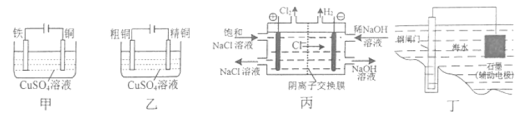
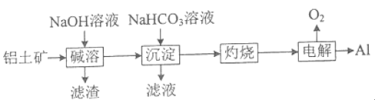
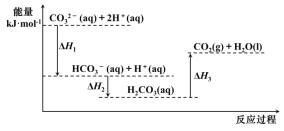题目内容
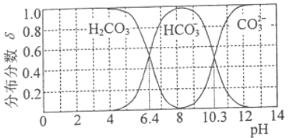
【题目】25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.l mol·L-1的溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如下图所示。下列有关离子浓度关系叙述一定正确的是( )
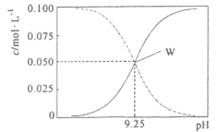
A.W点表示溶液中:c(NH3·H2O)+c(H+)=c(Cl-)+c(OH-)
B.pH=7.0溶液中: c(NH3·H2O)>c(NH4+)>c(OH-)=c(H+)
C.pH=10.5的溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
D.向W点所表示的1 L溶液中加入0.05 mol NaOH固体(忽略溶液体积变化):c(Na+)>c(Cl-)>c(OH-)>c(NH4+)
【答案】AD
【解析】
将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.l mol/L的混合溶液,当溶液中只有NH4+时,NH4+水解使溶液呈酸性,随着c(NH3·H2O)的增大,溶液碱性增强,根据图示,当pH=9.25时,c(NH3·H2O)=c(NH4+),因此当溶液的pH<9.25时,c(NH3·H2O)<c(NH4+),当pH>9.25时,c(NH3·H2O)>c(NH4+),因此随着溶液pH的增大,浓度增大的是c(NH3·H2O)、减小的是c(NH4+)。
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒可得c(Cl-)+c(OH-)=c(NH4+)+c(H+),在W点时c(NH3·H2O)=c(NH4+),所以c(NH3·H2O)+c(H+)=c(Cl-)+c(OH-),A正确;
B.室温下pH=7.0<9.25,溶液显中性,c(H+)=c(OH-),则溶液中c(NH4+)>c(NH3·H2O),NH3·H2O主要以电解质分子存在,NH3·H2O、H2O的电离程度十分微弱,其电离产生的离子浓度很小,故微粒浓度大小关系为:c(NH4+)>c(NH3·H2O)>c(H+)=c(OH-),B错误;
C.该混合溶液中,无论pH如何变化都存在c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(Cl-)+c(OH-)+c(NH3·H2O)=c(NH4+)+c(H+)+c(NH3·H2O)=0.1 mol/L+c(H+)>0.1 mol/L,C错误;
D.W点溶液中存在c(NH3·H2O)=c(NH4+)=0.05 mol/L,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知c(Cl-)<c(NH4+)=0.05 mol/L,向1 L该溶液中加入0.05 mol NaOH,则c(Na+)=0.05 mol/L, c(Na+)>c(Cl-),NaCl电离产生离子浓度Cl-浓度c(Cl-)大于NH3·H2O电离产生的离子NH4+、OH-的浓度,且溶液中还有水会微弱电离产生OH-,故离子浓度关系为:c(Na+)>c(Cl-)>c(OH-)>c(NH4+),D正确;
故合理选项是AD。

 应用题作业本系列答案
应用题作业本系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。