题目内容
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断正确的是
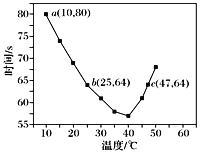
A.40 ℃之前,温度升高反应速率减慢,变蓝时间变长
B.40 ℃之后溶液变蓝的时间随温度的升高变短
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
【答案】D
【解析】
A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,故A错误;
B. 40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,故B错误;
C.图中b、c点对应的反应温度不同,反应速率不同,故C错误;
D.a点时间为80s,浓度变化量为![]() =0.004mol/L,a点对应的NaHSO3反应速率
=0.004mol/L,a点对应的NaHSO3反应速率![]() =5.0×10-5mol·L-1·s-1,故D正确;
=5.0×10-5mol·L-1·s-1,故D正确;
答案选D。

【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。

Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:

则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)