题目内容
【题目】如图所示两套实验装置,分别回答下列问题。
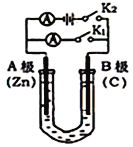
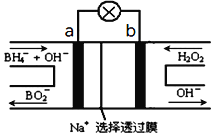
图1 图2
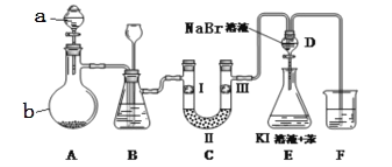
(1)如图1所示,U形管内盛有100mL的溶液,
①打开K2,闭合K1,若所盛溶液为CuSO4溶液:则B极的电极反应式为_______________________。
②打开K1,闭合K2,若所盛溶液为MgCl2溶液,则可观察到的现象是_________________________,总反应化学方程式是_________________________________。
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Ni2+浓度_____(填“增大”、“减小”、“不变”)。
(2)图2装置为硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。
①电池的负极反应式为__________________________
②放电时,每转移2mol电子,理论上需要消耗_________g NaBH4
【答案】Cu2++2e﹣═Cu AB两极都产生气体且A、B两极间溶液变浑浊 MgCl2+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑ 纯镍或精镍 减小 BH4-+8OH--8e-=BO2-+6H2O 9.5g
Mg(OH)2↓+H2↑+Cl2↑ 纯镍或精镍 减小 BH4-+8OH--8e-=BO2-+6H2O 9.5g
【解析】
(1)①打开K2,闭合K1,该装置为原电池, Zn作负极、B极的C作正极;
②打开K1,闭合K2,该装置是电解池,A为阴极、B为阳极;
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,粗镍作阳极、纯镍作阴极;
(2)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理解答该题。
(1)①打开K2,闭合K1,该装置为原电池,A极的Zn易失电子作负极,电极反应式为Zn-2e-=Zn2+,B极的C作正极,铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu;
答案:Cu2++2e﹣═Cu;
②打开K1,闭合K2,该装置是电解池,A为阴极,电极反应式为Mg2++2H2O+2e-=Mg(OH)2↓+H2↑;B为阳极,电极反应式为2Cl--2e-=Cl2↑,总反应为MgCl2+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑;
Mg(OH)2↓+H2↑+Cl2↑;
答案:AB两极都产生气体且A、B两极间溶液变浑浊;MgCl2+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑;
Mg(OH)2↓+H2↑+Cl2↑;
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,粗镍作阳极,纯镍作阴极,电解精炼是电解质溶液浓度略有减小,基本不变;
答案:纯镍或精镍;减小;
(2)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,根据电极反应式可知每转移2mol电子,理论上需要消耗NaBH40.25mol,质量为0.25mol×38g/mol=9.5g;
答案:BH4-+8OH--8e-=BO2-+6H2O;9.5g。

【题目】甲酸![]() 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。

Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸![]() 与甲醇
与甲醇![]() 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
沸点/℃ | 密度 | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是__________,长玻璃管c的作用是__________、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,![]() 能与
能与![]() 固体发生反应:
固体发生反应:![]() 。
。
(1)如图所示是以甲酸钠![]() 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:

则a极电极反应式为_______________。
(2)测定产物中甲酸钠![]() 的纯度:
的纯度:![]() 与足量
与足量![]() 充分反应后,消耗标况下
充分反应后,消耗标况下![]() ,所得固体物质为
,所得固体物质为![]() ,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
,则所得固体物质中甲酸钠的质量分数为_______(计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________(用离子方程式表示)