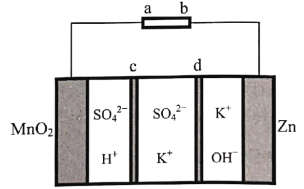
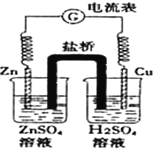
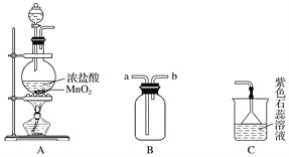
题目内容
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_________(写化学式,下同)。写出“乙![]() 丙”转化的离子方程式:______________________。
丙”转化的离子方程式:______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________。写出“甲![]() 乙”转化的离子方程式:_________________。
乙”转化的离子方程式:_________________。
【答案】Al2O3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Fe2O3 Fe2O3+6H+=2Fe3++3H2O
【解析】
(1)甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则其为铝的化合物,与硫酸反应生成硫酸铝,与氨水反应生成的丙为Al(OH)3和硫酸铵,分解生成的甲为Al2O3。
(2)乙溶液中加入KSCN溶液,有红色出现,则乙为Fe2(SO4)3,与氨水反应生成的丙为Fe(OH)3和硫酸铵,分解产物甲为Fe2O3。
(1)据甲的性质及相关转化可知,甲为Al2O3,乙为Al2(SO4)3,丙为Al(OH)3。
则甲是Al2O3。“乙![]() 丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(2)据乙溶液的性质及相关转化可知,甲为Fe2O3,乙为Fe2(SO4)3,丙为Fe(OH)3。
则甲物质是Fe2O3。写出“甲![]() 乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。
乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。

【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
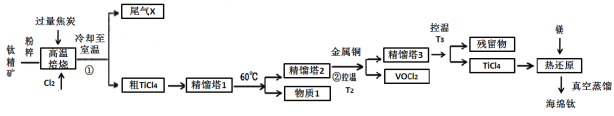
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
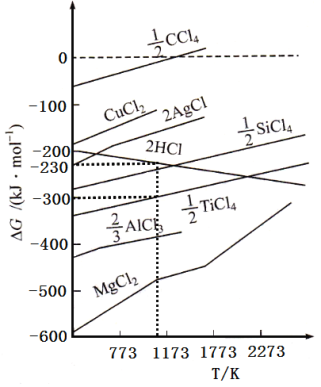
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)