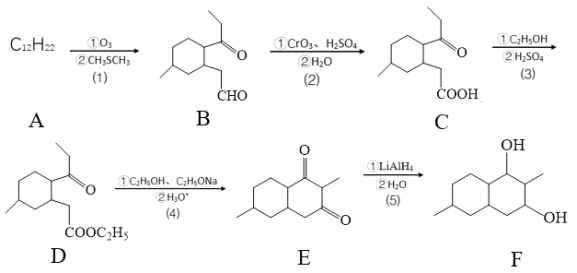
ЬтФПФкШн
ЁОЬтФПЁПЙЄвЕЩЯгУюбОЋПѓ(жївЊГЩЗжTiO2ЃЌПѓЗлжаКЌгаFeЃЌAlЃЌSiЃЌVЕШбѕЛЏЮя)жЦБИКЃУрюбЕФЛљБОЫМТЗЪЧЃКТШЛЏЗЈЩњВњTiCl4ЁЂЛЙдЁЂецПееєСѓЗЈжЦБИКЃУрюб(Ti)ЁЃ
вбжЊЃКЂйТШЛЏЙ§ГЬжаЃЌЦфЫћдЊЫиОљзЊЛЏЮЊзюИпМлТШЛЏЮяЃЛ
ЂкШШЛЙдЙ§ГЬжаЃЌПЩФмЛсгаИБВњЮяTiCl3ЃЛ
ЂлГЃМћЮяжЪШлЗаЕу
ЛЏКЯЮя | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
ЗаЕу | 136 | 56 | 308 | 180(Щ§ЛЊ) | 134 | 168 | 1412 | 3260 | 1090 |
ШлЕу | -69 | -25 | 304 | 190 | -78.9 | ЁЊЁЊ | 712 | 1668 | 648.9 |
ЛиД№ЯТСаЮЪЬтЃК
(1)НЋюбОЋПѓЗлДтЕФФПЕФЪЧЃК_______________
(2)ТШЛЏЙ§ГЬжаЃЌTiO2ЗЂЩњЕФЛЏбЇЗНГЬЪНЂйЪЧЃК_____________
(3)ЮяжЪ1ЪЧ________ЃЌВНжшЂкжаН№ЪєЭЕФзїгУЪЧНЋVOCl3ЛЙдГЩVOCl2ЃЌЦфФПЕФЪЧ_____________ЃЛ
(4)ЙЄвЕЩЯГЃгУMgЛђH2зїЛЙдМСЃЌдкArЦјЗеЯТВЩгУШШЛЙдЗЈжЦКЃУрюбЁЃ
ЂйУОВЛзуЪБЃЌTiCl4ЛсвђгаИБВњЮяВњЩњЖјЕМжТВњТЪЛсЯТНЕЃЌИБЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________ЃЛДЫДІВЩгУецПееєСѓЗЈГ§ШЅКЃУрюбжаЕФMgКЭMgCl2ЃЌВЛВЩгУГЃбЙеєСѓЕФдвђЪЧ_______ЁЃ
ЂкИљОнЭМЯѓЃЌМЦЫу1173KЪБЃЌЗДгІ2H2+TiCl4 =Ti+4HClЕФЁїG=_________ЁЃ
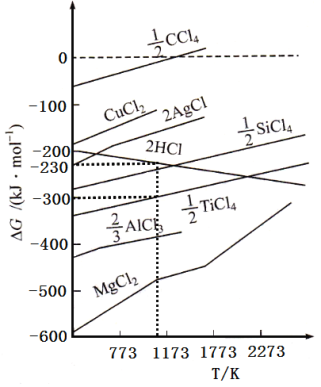
(GЮЊздгЩФмЃЌЭМжаЁїGЪЧжИдквЛЖЈЮТЖШЯТЃЌгЩЕЅжЪЩњГЩЖдгІЮяжЪЕФСПЛЏКЯЮяЪБЕФздгЩФмБфЛЏЁЃЩшДЫЮТЖШЯТЃЌЕЅжЪЕФЩњГЩздгЩФмБфЛЏЮЊ0)
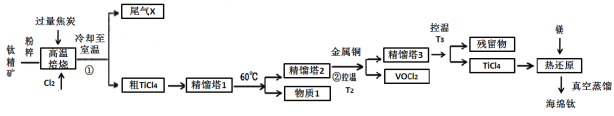
ЁОД№АИЁПдіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪЃЌЬсИпдСЯРћгУТЪ TiO2+2C+2Cl2![]() TiCl4+2CO SiCl4 ЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4 3TiCl4+Ti
TiCl4+2CO SiCl4 ЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4 3TiCl4+Ti![]() 4TiCl3 НЕЕЭеєСѓЮТЖШЃЌБмУтюбгыПеЦјжаЕФбѕЦјЃЌЕЊЦјЕШЮяжЪЗДгІ +140 kJ/mol
4TiCl3 НЕЕЭеєСѓЮТЖШЃЌБмУтюбгыПеЦјжаЕФбѕЦјЃЌЕЊЦјЕШЮяжЪЗДгІ +140 kJ/mol
ЁОНтЮіЁП
юбОЋПѓ(жївЊГЩЗжTiO2ЃЌПѓЗлжаКЌгаFeЃЌAlЃЌSiЃЌVЕШбѕЛЏЮя)ЗлЫщКѓгыНЙЬПЁЂCl2дкИпЮТЯТЗЂЩњЗДгІЃКTiO2+2C+2Cl2![]() TiCl4+2COЃЌдгжЪFeЩњГЩFeCl3ЃЌAlЩњГЩAlCl3ЃЌVБфЮЊVOCl3ЃЌSiБфЮЊSiCl4ЃЛШЛКѓРфШДжСЪвЮТЃЌЕУЕНЕФЮВЦјXжївЊКЌгаCOЃЌНЋДжTiCl4МгШыОЋСѓЫў1жаМгШШжС60ЁцЃЌИљОнБэИёжаЮяжЪЕФЗаЕуПЩжЊжЛгаSiCl4ЗаЕуЕЭгк60ЁцЃЌЫљвдЕУЕНЮяжЪ1ЮЊSiCl4ЃЛНЋЦфЫќвКЬхЮяжЪМгШыОЋСѓЫў2жаЃЌдйМгШыН№ЪєCuЃЌВЂПижЦдквЛЖЈЮТЖШЃЌЗЂЩњЗДгІЃКCu+2VOCl3
TiCl4+2COЃЌдгжЪFeЩњГЩFeCl3ЃЌAlЩњГЩAlCl3ЃЌVБфЮЊVOCl3ЃЌSiБфЮЊSiCl4ЃЛШЛКѓРфШДжСЪвЮТЃЌЕУЕНЕФЮВЦјXжївЊКЌгаCOЃЌНЋДжTiCl4МгШыОЋСѓЫў1жаМгШШжС60ЁцЃЌИљОнБэИёжаЮяжЪЕФЗаЕуПЩжЊжЛгаSiCl4ЗаЕуЕЭгк60ЁцЃЌЫљвдЕУЕНЮяжЪ1ЮЊSiCl4ЃЛНЋЦфЫќвКЬхЮяжЪМгШыОЋСѓЫў2жаЃЌдйМгШыН№ЪєCuЃЌВЂПижЦдквЛЖЈЮТЖШЃЌЗЂЩњЗДгІЃКCu+2VOCl3![]() 2VOCl2+CuCl2ЃЌЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4ЃЛНЋЗжРыГіVOCl2КѓЕФЮяжЪНјШыОЋСѓЫў3жаЃЌПижЦЮТЖШдкT3ЃЌЪеМЏ136ЁцЕФСѓЗжЃЌОЭЕУЕНДПОЛЕФTiCl4ЃЌШЛКѓгУMgЛЙдЃЌОецПееєСѓЕУЕНКЃУрюбЁЃ
2VOCl2+CuCl2ЃЌЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4ЃЛНЋЗжРыГіVOCl2КѓЕФЮяжЪНјШыОЋСѓЫў3жаЃЌПижЦЮТЖШдкT3ЃЌЪеМЏ136ЁцЕФСѓЗжЃЌОЭЕУЕНДПОЛЕФTiCl4ЃЌШЛКѓгУMgЛЙдЃЌОецПееєСѓЕУЕНКЃУрюбЁЃ
(1)НЋюбОЋПѓЗлДтЕФФПЕФЪЧдіДѓЗДгІЮяЕФНгДЅУцЛ§ЃЌМгПьЗДгІЫйТЪЃЌДгЖјЬсИпдСЯРћгУТЪЃЛ
(2)дкТШЛЏЙ§ГЬжаЃЌTiO2гыCЁЂCl2дкИпЮТЯТЗЂЩњбѕЛЏЛЙдЗДгІЃЌВњЩњTiCl4ЁЂCOЃЌЗДгІЕФЛЏбЇЗНГЬЪНЂйЪЧЃКTiO2+2C+2Cl2![]() TiCl4+2COЃЛ
TiCl4+2COЃЛ
(3)ОЩЯЪіЗжЮіПЩжЊЮяжЪ1ЪЧЗаЕуНЯЕЭЕФSiCl4ЃЛВНжшЂкжаН№ЪєЭЕФзїгУЪЧгыVOCl3ЗЂЩњбѕЛЏЛЙдЗДгІЃКCu+2VOCl3![]() 2VOCl2+CuCl2ЃЌДгЖјПЩЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4ЃЛ
2VOCl2+CuCl2ЃЌДгЖјПЩЪЙVOCl3ЛЙдЮЊНЯИпЗаЕуЕФVOCl2ЃЌБугкЗжРыЬсДПTiCl4ЃЛ
(4)ЂйУОВЛзуЪБЃЌTiCl4ЛсгыЗДгІВњЩњЕФTiЗЂЩњИБЗДгІЃК3TiCl4+Ti![]() 4TiCl3ЃЌвђгаИБВњЮяВњЩњЖјЕМжТВњТЪЛсЯТНЕЃЛДЫДІВЩгУецПееєСѓЗЈГ§ШЅКЃУрюбжаЕФMgКЭMgCl2ЃЌЖјВЛВЩгУГЃбЙеєСѓЪЧИљОнбЙЧПЖдЮяжЪЗаЕуЕФгАЯьЃЌецПееєСѓФмЙЛНЕЕЭеєСѓЮТЖШЃЌБмУтюбгыПеЦјжаЕФбѕЦјЃЌЕЊЦјЕШЮяжЪЗДгІЃЛ
4TiCl3ЃЌвђгаИБВњЮяВњЩњЖјЕМжТВњТЪЛсЯТНЕЃЛДЫДІВЩгУецПееєСѓЗЈГ§ШЅКЃУрюбжаЕФMgКЭMgCl2ЃЌЖјВЛВЩгУГЃбЙеєСѓЪЧИљОнбЙЧПЖдЮяжЪЗаЕуЕФгАЯьЃЌецПееєСѓФмЙЛНЕЕЭеєСѓЮТЖШЃЌБмУтюбгыПеЦјжаЕФбѕЦјЃЌЕЊЦјЕШЮяжЪЗДгІЃЛ
ЂкгЩгкЩшДЫЮТЖШЯТЃЌЕЅжЪЕФЩњГЩздгЩФмБфЛЏЮЊ0ЃЌИљОнЭМЯѓПЩжЊЃЌПЩжЊTiCl4ЕФЩњГЩздгЩФмЮЊ2ЁС(-300) kJ/mol=600 kJ/molЃЌ4 mol HClЕФЩњГЩздгЩФмЮЊ2ЁС(-230 )kJ/mol=-460 kJ/molЃЌЫљвддк1173KЪБЃЌЗДгІ2H2+TiCl4 =Ti+4HClЕФЁїG=600 kJ/mol-460 kJ/mol=+140 kJ/molЁЃ

 РшУїЮФЛЏКЎМйзївЕЯЕСаД№АИ
РшУїЮФЛЏКЎМйзївЕЯЕСаД№АИ КЎМйЬьЕижиЧьГіАцЩчЯЕСаД№АИ
КЎМйЬьЕижиЧьГіАцЩчЯЕСаД№АИЁОЬтФПЁП2018ФъЃЌУРЙњЭЫГіСЫЁЖАЭРшаЖЈЁЗЪЕаадйЙЄвЕЛЏеНТдЃЌЖјжаЙњШДМгДѓСЫЛЗБЃСІЖШЃЌЩњЖЏкЙЪЭСЫЮвЙњИКд№ШЮЕФДѓЙњаЮЯѓЁЃНќФъЮвЙњДѓСІМгЧПЮТЪвЦјЬхCO2ДпЛЏЧтЛЏКЯГЩМзДМММЪѕЕФЙЄвЕЛЏСПВњбаОПЃЌЪЕЯжПЩГжајЗЂеЙЁЃ
ЃЈ1ЃЉвбжЊЃКCO2(g)+H2(g)![]() H2O(g) +CO(g)ЁЁІЄH1 = + 41.1 kJmol-1
H2O(g) +CO(g)ЁЁІЄH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g)ЁЁІЄH2=Ѓ90.0 kJmol-1
CH3OH(g)ЁЁІЄH2=Ѓ90.0 kJmol-1
аДГіCO2ДпЛЏЧтЛЏКЯГЩМзДМЕФШШЛЏбЇЗНГЬЪНЃК_______ЁЃ
ЃЈ2ЃЉЮЊЬсИпCH3OHВњТЪЃЌРэТлЩЯгІВЩгУЕФЬѕМўЪЧ_______ЃЈЬюзжФИЃЉЁЃ
a.ИпЮТИпбЙ b.ЕЭЮТЕЭбЙ c.ИпЮТЕЭбЙ d.ЕЭЮТИпбЙ
ЃЈ3ЃЉ250ЁцЁЂдкКуШнУмБеШнЦїжагЩCO2(g)ДпЛЏЧтЛЏКЯГЩCH3OH(g)ЃЌЯТЭМЮЊВЛЭЌЭЖСЯБШ[n(H2)/n(CO2)]ЪБФГЗДгІЮяXЦНКтзЊЛЏТЪБфЛЏЧњЯпЁЃ
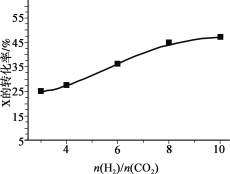
Ђй ЗДгІЮяXЪЧ_______ЃЈЬюЁАCO2ЁБЛђЁАH2ЁБЃЉЁЃ
Ђк ХаЖЯвРОнЪЧ_______ЁЃ
ЃЈ4ЃЉ250ЁцЁЂдкЬхЛ§ЮЊ2.0LЕФКуШнУмБеШнЦїжаМгШы6mol H2ЁЂ2mol CO2КЭДпЛЏМСЃЌ10minЪБЗДгІДяЕНЦНКтЃЌВтЕУc(CH3OH) = 0.75 molЁЄ LЃ1ЁЃ
Ђй ЧА10minЕФЦНОљЗДгІЫйТЪv(H2)ЃН_______ molЁЄLЃ1ЁЄmin Ѓ1ЁЃ
Ђк ЛЏбЇЦНКтГЃЪ§K = _______ЁЃ
Ђл ДпЛЏМСКЭЗДгІЬѕМўгыЗДгІЮязЊЛЏТЪКЭВњЮяЕФбЁдёадгаИпЖШЯрЙиЁЃПижЦЯрЭЌЭЖСЯБШКЭЯрЭЌЗДгІЪБМфЃЌЫФзщЪЕбщЪ§ОнШчЯТЃК
ЪЕбщБрКХ | ЮТЖШЃЈKЃЉ | ДпЛЏМС | CO2зЊЛЏТЪЃЈ%ЃЉ | МзДМбЁдёадЃЈ%ЃЉ |
A | 543 | Cu/ZnOФЩУзАє | 12.3 | 42.3 |
B | 543 | Cu/ZnOФЩУзЦЌ | 11.9 | 72.7 |
C | 553 | Cu/ZnOФЩУзАє | 15.3 | 39.1 |
D | span>553 | Cu/ZnOФЩУзЦЌ | 12.0 | 70.6 |
ИљОнЩЯБэЫљИјЪ§ОнЃЌгУCO2ЩњВњМзДМЕФзюгХбЁЯюЮЊ_______ЃЈЬюзжФИЃЉЁЃ