题目内容
【题目】(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
 △H=+88.62 kJ/mol
△H=+88.62 kJ/mol
以下叙述错误的是________(填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8 d.NBD能使溴水褪色
e. NBD及Q的一氯代物均为三种
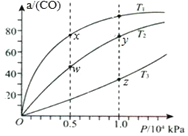
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响,实验1和3表明,____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_______,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。

【答案】a a c e 5 固体反应物的表面积 形成原电池 AB 0.06mol·L-1·min-1
【解析】
(1)△H>0,为吸热反应,结合原降冰片二烯(NBD)和四环烷(Q)的结构分析判断;
(2)充入一定量的NO2气体后,发生反应2NO2(g)N2O4(g),当正逆反应速率相等时平衡达平衡,据此分析解答;
(3)根据影响化学反应速率的因素结合实验数据分析解答①和②;③根据图像,计算各时间段内生成氢气的体积判断,根据氢气的体积计算出消耗的硫酸的物质的量,再结合v=![]() 计算速率。
计算速率。
(1)a.△H>0,说明反应物(NBD)的总能量小于生成物(Q)的总能量,故a错误;b.二者分子式相同,但结构不同,属于同分异构体,故b正确;c.由结构简式可知分子中能够含有7个C、8个H,则分子式为C7H8,故c正确;d.NBD结构中含有C=C,能够与溴发生加成反应,使溴水褪色,故d正确;e. NBD及Q的一氯代物均为三种,如图 、
、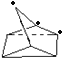 ,故e正确;故答案为:a;
,故e正确;故答案为:a;
(2)a.t1时,正反应速率大于逆反应速率,则反应未达到平衡,反应向正反应方向进行,所以NO2浓度在减小,故a正确;b.t2时,正逆反应速率相等,反应达平衡状态,化学平衡为动态平衡,反应没有停止,故b错误;c.t2~t3,为平衡状态,各物质浓度不再变化,故c正确;d.t2~t3,正逆反应速率相等,反应达平衡状态,各物质浓度不再变化,但浓度不一定相等,故d错误;e.0~t2,正反应速率大于逆反应速率,反应未达到平衡,反应向正反应方向进行,所以N2O4浓度增大,故e正确;f.反应过程中,N2O4浓度增大,气体的颜色变浅,故f错误;故答案为:ace;
(3)①第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池反应,因此反应速率最快,锌完全消失所需的时间最短,故答案为:5;
②实验1和2除固体表面积不同外,其它因素相同,说明固体反应物的表面积对速率有影响,实验3比1多了形成Zn-Cu原电池反应,说明形成原电池也会影响化学反应速率,故答案为:固体反应物的表面积;形成原电池;
③从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大;2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为![]() =6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×10-3mol,则v(H2SO4)=
=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×10-3mol,则v(H2SO4)=![]() =
= =0.06molL-1min-1,故答案为:AB;0.06molL-1min-1。
=0.06molL-1min-1,故答案为:AB;0.06molL-1min-1。