��Ŀ����
����Ŀ��SO2�ĺ����Ǻ��������Ⱦ��һ����Ҫָ�꣬��ҵ�ϳ����ô���ԭ�������շ�����SO2�����ô���ԭSO2����������SO2��Ⱦ�����ҿɵõ��о��ü�ֵ�ĵ���S��
��1���ڸ�����ִ��������£�CH4��ʹSO2ת��ΪS��ͬʱ����CO2��H2O��
��֪CH4��S��ȼ����(��H)�ֱ�Ϊ-890.3k/mol��-297.2kJ/mol����CH4��SO2��Ӧ���Ȼ�ѧ����ʽΪ_____________��
��2����H2��ԭSO2����S�ķ�Ӧ��������ɣ���ͼ1��ʾ���ù�����������ʵ����ʵ���Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ:
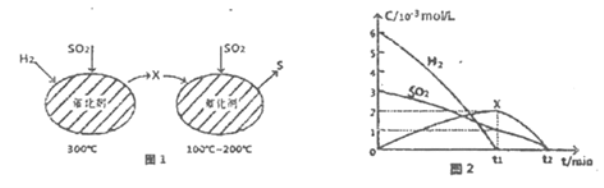
�ٷ�����֪XΪ______(д��ѧʽ)��0��t1ʱ��ε��¶�Ϊ_____��0��t1ʱ�����SOz��ʾ�Ļ�ѧ��Ӧ����Ϊ________��
���ܷ�Ӧ�Ļ�ѧ����ʽΪ_____________��
��3����̿����ԭSO2����S2,��ѧ����ʽΪ:2C(s)+2SO2(g)![]() S2(g)+2CO2(g)�����������У�1mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ3��ʾ��
S2(g)+2CO2(g)�����������У�1mol/LSO2�������Ľ�̿��Ӧ��SO2��ת�������¶ȵı仯��ͼ3��ʾ��

�ٸ÷�Ӧ����H____0(����>������<��)
����a���ƽ�ⳣ��Ϊ_________��
��4����ҵ�Ͽ���Na2SO3��Һ���շ�����SO2,25��ʱ��1mo/L��Na2SO3��Һ����SO2������ҺpH=7ʱ����Һ�и�����Ũ�ȵĴ�С��ϵΪ________����֪:H2SO3�ĵ��볣��K1=1.3��10-2��K2=6.2��10-8
���𰸡� CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ��H=-295.9kJ/mol H2S 300�� 2��10-3/t1mol/(L��min) 2H2+SO2![]() S+2H2O < 36.45mol/L c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
S+2H2O < 36.45mol/L c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
��������(1)CH4��S��ȼ���ȷֱ�Ϊ890.3kJ/mol��297.2kJ/mol����֪�Ȼ�ѧ����ʽ����CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-890.3kJ/mol����S(s)+O2(g)�TSO2(g)��H=-297.2kJ/mol�����ݸ�˹���ɣ�����-����2�ɵ�CH4(g)+2SO2(g)�TCO2(g)+2S(s)+2H2O(l)��H=-295.9kJ/mol���ʴ�Ϊ��CH4(g)+2SO2(g)�TCO2(g)+2S(s)+2H2O(l)��H=-295.9kJ/mol��
(2)�ٸ���ͼ1��֪����300��ʱ��SO2��H2��Ӧ����H2S����100�浽200��ʱ��H2S��SO2��Ӧ����S��ˮ����XΪH2S����ͼ2�У�0��t1ʱ���SO2��H2��Ũ�Ƚ��ͣ�H2S��Ũ�����ߣ���0��t1ʱ����¶�Ϊ300�棻��SO2��ʾ�Ļ�ѧ��Ӧ����v=![]() =
=![]() =
=![]() ��103 mol/(L�� min)���ʴ�Ϊ��H2S��300����
��103 mol/(L�� min)���ʴ�Ϊ��H2S��300����![]() ��103 mol/(L�� min)��
��103 mol/(L�� min)��
�ڸ��ݷ�����֪��SO2��H2���շ�Ӧ����S��ˮ���ʻ�ѧ����ʽΪ2H2+SO2�TS+2H2O���ʴ�Ϊ��2H2+SO2�TS+2H2O��
(3)�ٸ���ͼ���֪�������¶ȣ�SO2��ת���ʽ��ͣ���ƽ�����ƣ��˷�ӦΪ���ȷ�Ӧ������H��0���ʴ�Ϊ������
�����ڵ�a�Ķ��������ת����Ϊ90%�����У�
2C(s)+2SO2(g)S2(g)+2CO2(g)
��ʼ(c)�� 1mol/L 0 0
ת��(c)�� 0.9mol/L0.45mol/L0.9mol/L
ƽ��(c)�� 0.1mol/L 0.45mol/L 0.9mol/L
��ƽ�ⳣ��K=![]() =
=![]() =36.45���ʴ�Ϊ��36.45��
=36.45���ʴ�Ϊ��36.45��
(4)Na2SO3��Һ����SO2����NaHSO3�����ӷ���ʽΪSO32-+SO2+H2O�T2HSO3-��25��ʱ��1mol/L��Na2SO3��Һ����SO2������ҺpH=7ʱ����Һ�е�����ΪNa2![]() ��֪
��֪![]() =0.62����c(HSO3-)��c(SO32-)�����У�c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)���ʴ�Ϊ��c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)��
=0.62����c(HSO3-)��c(SO32-)�����У�c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)���ʴ�Ϊ��c(Na+)��c(HSO3-)��c(SO32-)��c(H+)=c(OH-)��