题目内容
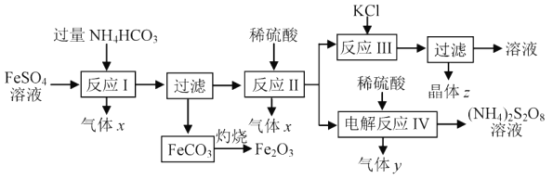
【题目】天然气水蒸汽重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,发生下表反应。
反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
①CH4(g)+ H2O(g) | a | 0.6 |
②CH4(g)+ 2H2O(g) | +165.0 | b |
③CO(g)+ H2O(g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=__________; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为 _______________。
(5)平衡时升温,CO含量将_________(选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[![]() ]值也会随着改变,在图中画出其变化趋势。________________
]值也会随着改变,在图中画出其变化趋势。________________
【答案】+206.2 1.32 A AB CH4 ![]() C+2H2 增大 0.6
C+2H2 增大 0.6 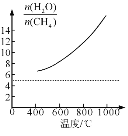
【解析】
⑴第②个方程式减去第③个方程式,方程式相减,平衡常数相除。
⑵根据影响反应速率和平衡移动的规律进行分析,但是要同时满足:既能加快反应又能提高CH4转化率;
⑶根据正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析;
⑷甲烷分解生成碳和氢气;
⑸平衡时升温,对反应①是平衡向吸热反应即正向移动,对反应③是平衡向吸热反应即逆向移动。
⑹根据得失电子守恒计算c(CO)平衡时浓度。
⑺反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,当反应发生时H2O与CH4物质的量之比![]() ,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此
,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此![]() 增大。
增大。
⑴第②个方程式减去第③个方程式得到a = +165.0(41.2) =+ 206.2,方程式相减,平衡常数相除,因此![]() ,解得b =1.32;故答案为:+206.2;1.32。
,解得b =1.32;故答案为:+206.2;1.32。
⑵对于反应②,
A.反应是吸热反应,升温,速率加快,平衡正向移动,CH4转化率增大,故A符合题意;
B.加催化剂,加快反应速率,但平衡不移动,故B不符合题意;
C.加压,加快反应速率,但平衡向体积减小方向即逆向移动,CH4转化率减小,故C不符合题意;
D.吸收CO2,生成物浓度减小,反应速率减慢,故D不符合题意;
综上所述,答案为A。
⑶A.体系中H2O与CH4物质的量之比不再变化,则达到平衡,故A符合题意;
B.体系中H2的体积分数保持不变,则达到平衡,故B符合题意;
C.生成n 个CO2的同时消耗2n个H2O,都是正方向,同一个方向,不能说明达到平衡,故C不符合题意;
D.υ正(CO)= υ逆(H2),反应体系中CO与H2的比例不清楚,因此不能说明达到平衡,故D不符合题意;
综上所述,答案为AB。
⑷该体系中产生碳的反应主要是甲烷分解生成碳和氢气,其方程式为CH4 ![]() C+2H2;
C+2H2;
故答案为:CH4 ![]() C+2H2;
C+2H2;
⑸反应①是吸热反应,反应③是放热反应,平衡时升温,对反应①是平衡向吸热反应即正向移动,对反应③是平衡向吸热反应即逆向移动,因此CO含量将增大;
故答案为:增大。
⑹一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75 molL1、4.80 molL1,根据得失电子守恒,CH4到CO2升高8价,CH4到CO升高6价,甲烷或水到H2降低2个价态,因此8×0.75 molL1 +6c(CO) =2×4.80 molL1,解得c(CO) =0.6 molL1;
故答案为:0.6;
⑺反应容器中通入甲烷与为水蒸汽体积比为1:5的混合气体,当反应发生时H2O与CH4物质的量之比![]() ,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此
,开始改变上述平衡体系的温度,对①和②平衡向吸热反应移动即正向移动,对③平衡逆向移动,因此![]() 增大,在图中画出其变化趋势为
增大,在图中画出其变化趋势为 ;
;
故答案为: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】氨是一种重要的化工产品。
(1)标准状况下,1 mol NH3的体积约为________L。
(2)实验室制取NH3的化学方程式为______________。
(3)收集NH3应使用________法,要得到干燥的NH3可选用___做干燥剂。
(4)压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与 NH3 含量的一些实验数据:
压强MPa | 10 | 20 | 30 | 60 | 100 |
NH3含量(体积分数%) | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量随之___(填字母)。
A.增大 B.减小 C.先增大再减小 D.不变