题目内容
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
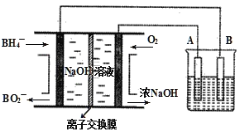
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH4+8OH--8e-=BO2-+6H2O
C.电解池中的电解质溶液可以选择CuCl2溶液
D.每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
【答案】D
【解析】
燃料电池中通入氧气的一极,氧气得电子生成氢氧根离子,该电极为正极。
A. 氧气得电子产生氢氧根离子,钠离子通过交换膜进入右边得到浓的氢氧化钠,故离子交换膜允许钠离子通过,是阳离子交换膜,A项正确;
B. 根据图示,负极BH4-转化为BO2-,故反应式为BH4-+8OH--8e-=BO2-+6H2O,B项正确;
C. 电解池是电解精炼铜,电解质溶液必须含有铜离子,可以选择CuCl2溶液,C项正确;
D. A极连接正极,作为阳极,每消耗2.24LO2(标准状况)时,转移电子![]() =0.4mol,A电极为铜时,质量减轻
=0.4mol,A电极为铜时,质量减轻![]() =12.8g,但是A为粗铜,可能有其他金属参与反应,质量减少不一定为12.8g,D项错误;
=12.8g,但是A为粗铜,可能有其他金属参与反应,质量减少不一定为12.8g,D项错误;
答案选D。

【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30mol、PCl3 0.45 mol和Cl2 0.15 mol,则反应将向逆反应方向进行
【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是____(填字母)。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
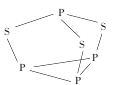
①P4S3分子中硫原子的杂化轨道类型为____。
②每个P4S3分子中含有的孤电子对的数目为____对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为____。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为____。
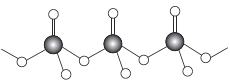
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为____。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是 ___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
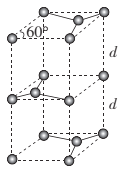
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg.cm-3,C-C键的键长为r cm,M为阿伏加德罗常数的值,则石墨晶体的层间距d= ___cm。
【题目】天然气水蒸汽重整法是工业上生产氢气的重要方法,反应在 400℃以上进行。l 00kPa 时,在反应容器中通入甲烷与为水蒸汽体积比为1 : 5的混合气体,发生下表反应。
反应方程式 | 焓变△H(kJ/mol) | 600℃时的平衡常数 |
①CH4(g)+ H2O(g) | a | 0.6 |
②CH4(g)+ 2H2O(g) | +165.0 | b |
③CO(g)+ H2O(g) | -41.2 | 2.2 |
请回答下列下列问题:
(1)上表中数据 a=__________; b= ___________ 。
(2)对于反应②,既能加快反应又能提高CH4转化率的措施是_____________。
A.升温 B.加催化剂 C.加压 D.吸收CO2
(3)下列情况能说明容器中各反应均达到平衡的是___________。
A.体系中H2O与CH4物质的量之比不再变化
B.体系中H2的体积分数保持不变
C.生成n 个CO2的同时消耗2n个H2O
D. v正(CO)= v逆(H2)
(4)工业重整制氢中,因副反应产生碳会影响催化效率,需要避免温度过高以减少积碳。该体系中产生碳的反应方程式为 _______________。
(5)平衡时升温,CO含量将_________(选填“增大”或“减小”)。
(6)一定温度下 ,平衡时测得体系中 CO2和H2的物质的量浓度分别是0.75mo l/L、4.80mol/L , 则此时体系中CO 物质的量浓度是_______ mol/L。
(7)改变上述平衡体系的温度,平衡时H2O与CH4物质的量之比[![]() ]值也会随着改变,在图中画出其变化趋势。________________
]值也会随着改变,在图中画出其变化趋势。________________