题目内容
19.在实验室中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有溴水(表面覆盖少量水).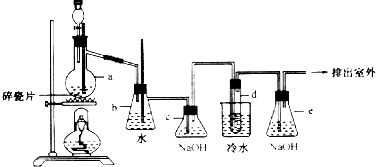
(1)写出乙醇与浓硫酸反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.试管d中发生反应的化学方程式CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的长导管发生的现象:b中水面会下降,玻璃管中的水柱会上升,甚至溢出.
(3)容器c中氢氧化钠溶液的作用是吸收乙烯气体中含有的CO2、SO2等酸性气体.
(4)容器e 中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染.
分析 (1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,试管d中乙烯与液溴发生加成反应;
(2)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(3)氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
(4)反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用e吸收.
解答 解:(1)实验室中用乙醇和浓硫酸加热来制取乙烯,然后用乙烯和溴单质的加成反应来制得1,2-二溴乙烷,发生反应的原理方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,试管d中乙烯与液溴发生加成反应生成1,2-二溴乙烷;CH2=CH2+Br2→CH2BrCH2Br,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;CH2=CH2+Br2→CH2BrCH2Br;
(2)根据大气压强原理,试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(3)浓硫酸具有强氧化性,能氧化乙醇,自身被还原成二氧化硫,所以含有杂质气体二氧化碳、二氧化硫,装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应,
故答案为:吸收乙烯气体中含有的CO2、SO2等酸性气体;
(4)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收HBr等气体,防止大气污染.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、解决问题的能力.

| A. | 在周期表中,原子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 位于 IA的元素与位于 VIIA的元素组成的化合物都是离子化合物 |
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 用制取氢气的装置制取乙炔 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |

| A. | 维生素A是一种烯烃 | |
| B. | 维生素A的一个分子中有30个氢原子 | |
| C. | 维生素A的一个分子中有五个双键 | |
| D. | 维生素A能使溴水褪色,能被酸性KMnO4氧化 |
| A. | 陶瓷 | B. | 橡胶 | C. | 塑料 | D. | 涤纶 |
| A. | Na、Mg、Al、Si的金属性逐渐增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
 .
. 维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.
维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.
