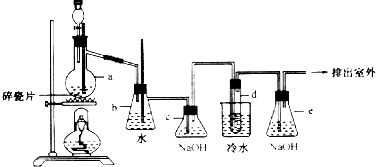
题目内容
7.下列实验能获得成功的是( )| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 用制取氢气的装置制取乙炔 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
分析 A.乙酸和乙醇共热制取乙酸乙酯必须要浓硫酸作催化剂;
B.碳化钙和水反应生成微溶物氢氧化钙;
C.Cu和氧气反应生成黑色的CuO,CuO和乙醇反应生成乙醛和Cu;
D.淀粉水解后显酸性,检验葡萄糖应在碱性条件下.
解答 解:A.乙醇和乙酸在浓硫酸的作用下混合共热才可以制取乙酸乙酯,故A错误;
B.碳化钙和水反应生成微溶物氢氧化钙,阻止进一步反应,故B错误;
C.Cu和氧气反应生成黑色的CuO,CuO和乙醇反应生成乙醛和Cu,所以将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色,故C正确;
D.淀粉水解后显酸性,检验葡萄糖应在碱性条件下,则淀粉用酸催化水解后的溶液加入新制银氨溶液水浴加热,观察不到银镜,应水解后先加碱至碱性再滴加银氨溶液,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及醛基检验、乙酸乙酯的制取、乙醇的催化氧化等知识点,注意把握反应中的现象、反应条件,会从实验操作的规范性及评价性、物质的性质方面分析解答,题目难度中等.

练习册系列答案
相关题目
17.四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8.下列说法不正确的是( )
| A. | 与W相邻的同主族元素可制成重要的半导体材料 | |
| B. | 元素的原子半径从大到小的顺序是X、Y、Z | |
| C. | WZ4分子中W、Z 原子最外层均达到8电子结构 | |
| D. | W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | IA族元素称为碱金属元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| D. | 地球上元素的分布和它们在元素周期表中的位置有密切关系 |
15.下列关于图所示原电池装置的叙述中,正确的是( )


| A. | 铜片是负极 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 有6.02×1022个电子经过导线时,锌片质量减少3.25g |
16.下列各项表达中正确的是( )
| A. | 聚丙烯的结构简式: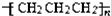 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: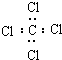 | D. | -CH3(甲基)的电子式为 |
17.下列叙述正确的是( )
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.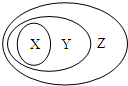 用图表示的一些物质或概念间的从属关系中错误的是( )
用图表示的一些物质或概念间的从属关系中错误的是( )