题目内容
8.下列递变规律正确的是( )| A. | Na、Mg、Al、Si的金属性逐渐增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
分析 A、根据同一周期,从左至右,元素的金属性逐渐减弱;
B、根据同一周期,从左至右,元素原子的半径逐渐减小以及同一主族,从上到下,元素原子的半径逐渐增大;
C、根据元素的非金属性越强其对应的氢化物越稳定;
D、据元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强;
解答 解:A、因同一周期,从左至右,元素的金属性逐渐减弱,则金属性:Na>Mg>Al>Si,故A错误;
B、因同一主族,从上到下,元素原子的半径逐渐增大,所以半径:S>O,K>Na,又因同一周期,从左至右,元素原子的半径逐渐减小,所以半径:Na>S;则半径:K>Na>S>O,故B正确;
C、因元素的非金属性越强其对应的氢化物越稳定,非金属性:F>Cl>S>P,所以稳定性:HF>HCl>H2S>PH3,故C错误;
D、因元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强,金属性:K>Ca>Mg>Al,
所以碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故D错误;
故选:B.
点评 本题主要考查了元素周期律的应用,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
18.关于元素周期表,下列叙述中不正确的是( )
| A. | IA族元素称为碱金属元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| D. | 地球上元素的分布和它们在元素周期表中的位置有密切关系 |
16.下列各项表达中正确的是( )
| A. | 聚丙烯的结构简式: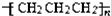 | B. | 乙醇的结构简式:CH3CH2OH | ||
| C. | 四氯化碳的电子式: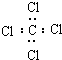 | D. | -CH3(甲基)的电子式为 |
3.同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是( )
| A. | 原子半径 Z>Y>X | |
| B. | Z的非金属性最强 | |
| C. | 氢化物还原性XH3>H2Y>HZ,稳定性XH3>H2Y>HZ | |
| D. | 最高氧化物对应水化物H3XO4酸性最强 |
17.下列叙述正确的是( )
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
18.下列关于晶体的说法正确的是( )
| A. | 晶体中只要有阳离子就一定有阴离子 | |
| B. | 氢键属于分子间作用力,不存在于分子内 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 构成分子晶体的微粒不一定含有共价键 |