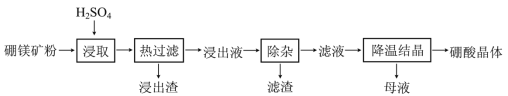
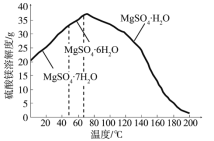
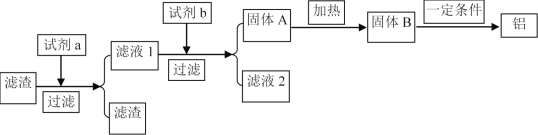
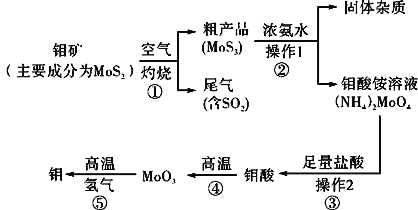
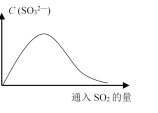
题目内容
【题目】下面两表分别列出了CO和N2 的某些性质及相关键能,有关说法不正确的是
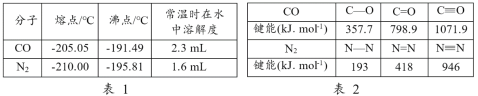
A.CO与N2的价电子总数相等
B.由表2可知,CO的活泼性不及N2
C.由表1可知,CO的熔沸点高于N2,是因为CO分子间作用力大于N2
D.由表2可知,σ键的稳定性不一定强于π键
【答案】B
【解析】
A.CO的价电子总数为6+4=10,N2的价电子总数为5+5=10,故A正确;
B.一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个π键比N2更容易断,所以一氧化碳比氮气活泼,故B错误;
C.一氧化碳和氮气形成晶体为分子晶体,分子间作用力越大,沸点越高,由表 1 可知,CO 的熔沸点高于 N2,是因为 CO 为极性分子,分子间作用力大于 N2 ,故C正确;
D.根据表格数据,CO分子中有一个π键的键能为798.9kJ/mol-357.7kJ/mol=441.2 kJ/mol,键能大于C-O单键即σ键的键能,更稳定,故D正确;
故答案为B。

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目