题目内容
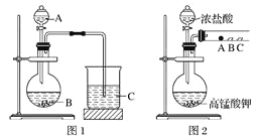
【题目】某实验小组设计了如下装置对焦炭还原二氧化硅气体产物的成分进行探究。
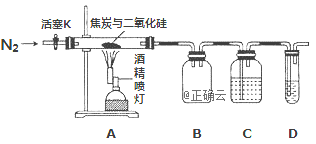
已知:PdCl2溶液可用于检验CO,反应的化学方程式为: CO+PdCl2 + H2O = CO2 +2HCl + Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是________
(2)装置B的作用是________
(3)装置C中所盛试剂应为___________
(4)该装置的缺点是________
【答案】排空气,避免空气中的O2、CO2、水蒸气对实验产生干扰 作安全瓶,防止倒吸 澄清石灰水 无尾气吸收装置
【解析】
根据题意可知,碳与二氧化硅反应要在高温下进行,而高温下碳与空气中氧气反应,所以实验时要将装置中的空气排尽,利用氮气排净装置内的空气,关闭活塞K,点燃酒精灯发生反应生成一氧化碳,装置B为安全瓶,根据元素守恒,碳与二氧化硅反应可能生成一氧化碳也可能生成二氧化碳,所以C装置用来检验有没有二氧化碳,D装置用来检验一氧化碳;通过装置D中PdCl2溶液检验一氧化碳生成的生成,据此分析作答。
(1)碳与二氧化硅反应要在高温下进行,而在高温下碳与空气中氧气、CO2、水蒸气反应,所以实验时要将装置中的空气排尽,所以实验时要通入足够长时间的N2,
故答案为:排空气,避免空气中的O2、CO2、水蒸气对实验产生干扰
(2)根据装置图可知,B装置可以作安全瓶,防止倒吸,
故答案为:作安全瓶,防止倒吸;
(3)C装置用来检验有没有二氧化碳,故C装置中所盛试剂应为澄清石灰水,
故答案为:澄清石灰水;
(4)一氧化碳有毒,能排放到空气中,而该装置没有能将CO吸收的尾气处理装置,
故答案为:无尾气吸收装置。

【题目】2 L密闭容器中进行反应:pZ(g)+qQ(g) ![]() mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知:2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
请回答下列问题:
(1)2 min内X的反应速率v(X)=__________。
(2)起始时n(Y)=__________。
(3) 3 min末是否达到平衡_______(填是或否)。
(4)对于该反应,能增大正反应速率的措施是________(填序号,下同)。
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度