题目内容
【题目】发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量红棕色的气体,产生红棕色的气体的原因是( )
A. NO遇空气生成NO2 B. 高温下N2遇空气生成NO2
C. CO2与N2反应生成CO和NO2 D. NO和H2O反应生成H2和NO2
【答案】A
【解析】A. NO遇空气与氧气反应生成红棕色NO2,A正确;B. 放电或高温下N2与氧气反应生成NO,B错误;C. CO2与N2不反应,C错误;D. NO和H2O不反应,D错误,答案选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
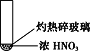
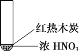
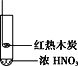
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应