题目内容
【题目】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的价电子排布式为nsnnpn |
Y | Y的负一价离子的电子层结构都与氩相同 |
Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(1)Z在元素周期表中的位置 _______________________,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________(用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________。
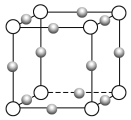
(5)Y元素和Na形成晶体的部分结构可用下图中的_________来表示(填序号)。
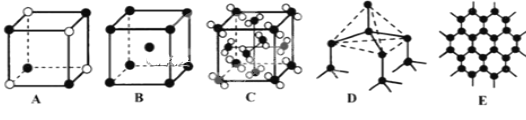
【答案】第三周期ⅥA族 V型 H—Cl sp 1s22s22p63s23p63d54s1 A
【解析】
s能级最多容纳2个电子,根据构造原理,推出X为C,Y的负一价离子的电子层结构都与氩相同,即Y为Cl,Z的单质是淡黄色固体,常在火山口附近沉积,则Z为S,W原子共有6个价电子,其中5个价电子位于第三能层d轨道,价电子排布式为3d54s1,即W为Cr;
s能级最多容纳2个电子,根据构造原理,推出X为C,Y的负一价离子的电子层结构都与氩相同,即Y为Cl,Z的单质是淡黄色固体,常在火山口附近沉积,则Z为S,W原子共有6个价电子,其中5个价电子位于第三能层d轨道,价电子排布式为3d54s1,即W为Cr;
(1)根据上述分析,S位于第三周期VIA族;Z的氢化物为H2S,S杂化类型为sp3,即H2S空间构型为V型;
(2)Cl的电负性强于S,因此H-Cl极性强于H-S;
(3)XZ2为CS2,结构式为S=C=S,C的杂化类型为sp;
(4)W为Cr,其核外电子排布式为1s22s22p63s23p63d54s1;
(5)Cl和Na形成的化合物是NaCl,NaCl属于离子化合物。A、黑球位于顶点,属于该晶胞的个数为4×1/8=1/2,白球位于顶点,属于该晶胞的个数为4×1/8=1/2,原子个数比为1:1,即化学式为NaCl,故A符合题意;
B、该晶体为单质晶体,故B不符合题意;
C、NaCl为离子化合物,是由Na+和Cl-组成,不存在“NaCl”分子,故C不符合题意;
D、该晶体为原子晶体的结构,故D不符合题意;
E、该结构为石墨结构,故E不符合题意。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案