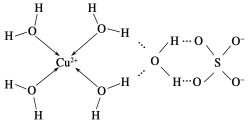
题目内容
【题目】某反应使用催化剂后,其反应过程中能量变化如图所示。下列说法错误的是
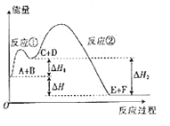
A. △H=△H1-△H2
B. 该反应的总反应为放热反应
C. 使用催化剂,不能改变反应进行的方向
D. 反应①是吸热反应,反应②是放热反应
【答案】A
【解析】
由图可知,反应物总能量低于生成物总能量,则A和B反应生成C和D的反应为吸热反应;反应物总能量高于生成物总能量,则C和D反应生成E和F的反应为放热反应,总反应A和B反应生成E和F的反应为放热反应,反应热△H=△H2-△H1。
A项、由图可知,A和B反应生成E和F的反应为放热反应,反应热△H=△H2-△H1,故A错误;
B项、反应物总能量高于生成物总能量,则总反应A和B反应生成E和F的反应为放热反应,故B正确;
C项、使用催化剂,能改变反应反应活化能,能改变反应的反应速率,不能改变反应进行的方向,故C正确;
D项、由图可知,反应物总能量低于生成物总能量,则A和B反应生成C和D的反应为吸热反应;反应物总能量高于生成物总能量,则C和D反应生成E和F的反应为放热反应,故D正确。
故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂