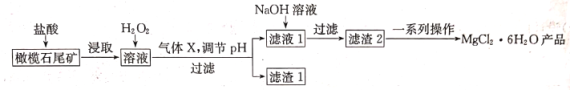
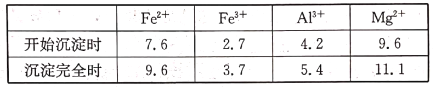
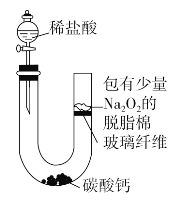
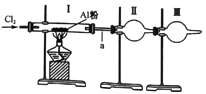
��Ŀ����
����Ŀ����һ���¶��µĺ��������У��Կ��淴Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�����������У���˵����Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
2SO3(g)�����������У���˵����Ӧ�Ѵﵽ��ѧƽ��״̬���ǣ� ��
�ٵ�λʱ���ڶ���a mol O=O����ͬʱ����2a mol SO3��SO2���ɵ�������SO3�ֽ��������Ȣ������ڵ�ѹǿ���ٱ仯�ܻ����������ʵ������ٱ仯�ݻ�������ƽ����Է����������ٱ仯���������ܶȲ��ٱ仯
A. �ڢۢ�B. �ڢܢ�C. �ۢܢ�D. �٢ڢ�
���𰸡�C
��������
���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣬�ݴ˷������
�ٵ�λʱ���ڶ���a mol O=O����ͬʱ����2a mol SO3������������Ӧ���ʣ�����ȷ���ﵽƽ��״̬���ʢٴ���SO2���ɵ�������SO3�ֽ�����ʣ���Ϊ�淴Ӧ������ȣ����жϷ�Ӧ�ﵽƽ��״̬���ʢڴ��������ڵ�ѹǿ���ٱ仯��˵���������������ʵ���������ʱ��仯���仯����ƽ��״̬���ʢ���ȷ��������Ӧ�ǻ�����������ʵ�����С�ķ��������������ʵ������ٱ仯����ƽ��״̬���ʢ���ȷ���ݻ����������������䣬�������������ʵ�����ȷ��������������ƽ����Է����������ٱ仯ʱ��˵�����������ʵ���������ʱ��仯���仯����ʱ��ƽ��״̬���ʢ���ȷ������������������������ʼ��һ��������������ܶȲ��ٱ仯����ȷ����ƽ��״̬���ʢ��ۢܢ���ȷ���ʴ�ΪC��

����Ŀ��ʵ������һδ֪Ũ�ȵ����ᣬijͬѧ��ʵ�����н���ʵ��ⶨ�����Ũ�ȡ������������գ�
����100mL0.10molL-1NaOH����Һ������������ƽ����___g���������ƹ��塣
ȡ20.00mL�������������ƿ�У����μ� 2~3�η�̪��ָʾ���������Ƶı� NaOH��Һ���еζ����ظ������ζ����� 2~3�Σ���¼�������£�
�ζ����� | ������������/mL | 0.10 mol/L NaOH ��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 20.00 | 2.00 | 28.15 |
�ڶ��� | 20.00 | 1.50 | 29.50 |
������ | 20.00 | 0.20 | 26.55 |
�ٸ�ʵ��ζ��ﵽ�յ�ı�־��_________
�ڸ����������ݣ��ɼ�����������Ũ��ԼΪ______����������λ��Ч���֣�
��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���_______����˫ѡ��
A �ζ��յ����ʱ���Ӷ��� B ��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ
C ��ƿˮϴ��δ���� D ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
E ����NaOH ����ʱ����������KOH����
����������ʵ�����Ƶ�0.10molL��1NaOH��Һ�ζ�δ֪Ũ�ȵ�CHCOOH��Һ����Ӧǡ����ȫʱ��������������ȷ����_____
A ��Һ�����ԣ���ѡ�ü��Ȼ��̪��ָʾ��
B ��Һ�����ԣ�ֻ��ѡ��ʯ����ָʾ��
C ��Һ�ʼ��ԣ���ѡ�ü��Ȼ��̪��ָʾ��
D ��Һ�ʼ��ԣ�ֻ��ѡ�÷�̪��ָʾ��