题目内容
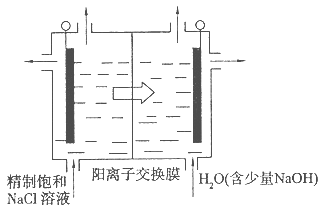
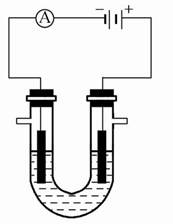
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
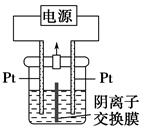
已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是 ( )。

已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是 ( )。
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含IO3— |
C.电解槽内发生反应的总化学方程式:KI+3H2O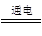 KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
D
左侧变蓝,说明左侧是阳极,I-在阳极放电,被氧化生成I2,因而右侧是阴极,只能是水电离的H+放电被还原生成H2,其电极反应为2H2O+
2e-=H2↑+2OH-,A项正确;阴离子交换膜允许阴离子通过,B项正确;电解KI的过程发生如下两个反应:
①2I-+2H2O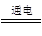 I2+2OH-+H2↑
I2+2OH-+H2↑
②3I2+6OH-=IO3—+5I-+3H2O
①×3+②即得总方程式,C项正确;如果将阴离子交换膜换成阳离子交换膜,阴极产生的OH-将不能到达阳极区,I2与OH-无法反应生成IO3—,因而D项错。
2e-=H2↑+2OH-,A项正确;阴离子交换膜允许阴离子通过,B项正确;电解KI的过程发生如下两个反应:
①2I-+2H2O
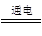 I2+2OH-+H2↑
I2+2OH-+H2↑②3I2+6OH-=IO3—+5I-+3H2O
①×3+②即得总方程式,C项正确;如果将阴离子交换膜换成阳离子交换膜,阴极产生的OH-将不能到达阳极区,I2与OH-无法反应生成IO3—,因而D项错。

练习册系列答案
相关题目

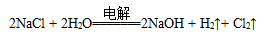

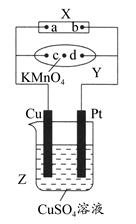
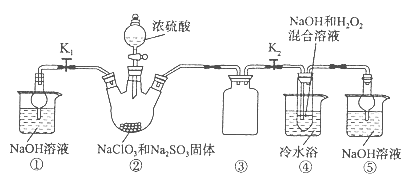

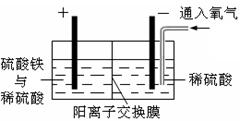
 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。