题目内容
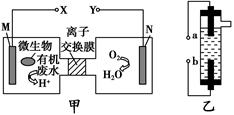
人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
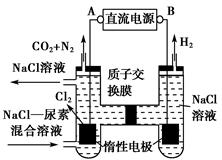
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为___________________________________、
___________________________________________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。

(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为___________________________________、
___________________________________________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
(1)B (2)2Cl--2e-=Cl2↑
CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
(3)不变 7.2
CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
(3)不变 7.2
(1)由图产生Cl2极为阳极知A为正极,B为负极。
(2)阳极室发生的反应依次为2Cl--2e-=Cl2↑。
由产物CO2、N2知CO(NH2)2在此室反应被氧化,CO(NH2)2―→CO2+N2,发生还原反应的为Cl2。故方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
(3)阴极室2H++2e-=H2↑。
阳极室产生的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变。pH与电解前相比不变。
两极共收集到的气体n(气体)=13.44/22.4=0.6 mol

m[CO(NH2)2]= =7.2 g
=7.2 g
(2)阳极室发生的反应依次为2Cl--2e-=Cl2↑。
由产物CO2、N2知CO(NH2)2在此室反应被氧化,CO(NH2)2―→CO2+N2,发生还原反应的为Cl2。故方程式为CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
(3)阴极室2H++2e-=H2↑。
阳极室产生的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变。pH与电解前相比不变。
两极共收集到的气体n(气体)=13.44/22.4=0.6 mol

m[CO(NH2)2]=
 =7.2 g
=7.2 g
练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目


 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。