��Ŀ����
����Ŀ����14�֣�ͭ���������ϵ�dz����е���ɫ��������֪�������£�����Һ��Cu2+�ȶ���Cu+�������������·�����Ӧ��2Cu+ =Cu2++Cu�������+1��ͭ�Ļ�������������磺Cu2O��CuI��CuCl��CuH�ȡ�
��1��������Cu��OH��2����Һ�е�����������Һ���������ɲ��������ɫΪ�� ��ijͬѧʵ��ʱȴ�к�ɫ���ʳ��֣����ֺ�ɫ���ʵĻ�ѧʽΪ�� ��
��2����CuCl2��Һ����μ������KI��Һ���ܷ�����
a.2Cu2++4I- =2CuI��(��ɫ)+I2
b.2Cu2++2Cl-+2I- =2CuCl��(��ɫ)+I2��
Ϊ˳���۲쵽��ɫ�������Լ��������Լ��� ��
A��SO2 B���� C��NaOH��Һ D���Ҵ�
��3��һ�������£���CuSO4�м���NH5��Ӧ�����⻯��ͭ��CuH����
����֪NH5�����Ӿ���������ԭ�Ӷ��ﵽϡ��������ȶ��ṹ����д��NH5�ĵ���ʽ�� ��
��д��CuH�ڹ���ϡ���������������ɵ����ӷ���ʽ ��
����CuH�ܽ���������ϡ�����У� ������л�ѧ����ʽ
![]()
��4�������£���0.20 mol L-1����ͭ��Һ�м�������������Һ������dz��ɫ������ͭ����������Һ��pH = 6ʱ��c(Cu2+)=________________mol.L1��
[��֪��![]()
![]() ]
]
���𰸡���14�֣���ÿ��2������1��ש��ɫ��CuO (2) B (3) ��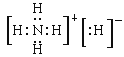
��2CuH + 2H+ ==Cu +Cu2+ + 2H2 �� ��6��16��6��3��4NO��8H2O 2.2��10-4
��������
�����������1��������Cu��OH��2����Һ�е�����������Һ�����ȷ���������ԭ��Ӧ����������ͭ�����������ˮ��������ɲ��������ɫΪש��ɫ��������ͭ���ȶ�����ת��Ϊ��ɫ������ͭ��������ֺ�ɫ���ʵĻ�ѧʽΪCuO��
��2��Ϊ˳���۲쵽��ɫ����������Ҫ�ѵ���ȡ���������Կ��Լ��������Լ�������ѡB��
��3������֪NH5�����Ӿ���������ԭ�Ӷ��ﵽϡ��������ȶ��ṹ����˵�������ӻ���������H-��笠����ֹ��ɵģ�����NH5�ĵ���ʽΪ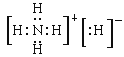 ��
��
��Cu+�������������·�����Ӧ2Cu+��Cu2++Cu����CuH�ڹ���ϡ���������������ɵ����ӷ���ʽΪ2CuH + 2H+ ==Cu +Cu2+ + 2H2 ����
���������ǿ�����ԣ����ͭת��Ϊ����ͭ����ԭ������NO�������ˮ���������ɣ�1molCuHʧȥ2�����ӣ��������������õ�3�����ӣ�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��ƽ��ķ���ʽΪ6CuH��16HNO3��6Cu(NO3)2��3H2����4NO����8H2O.
��4����ҺpH��6�������������ӵ�Ũ��ˮ10��8mol/L�����Ը���������ͭ���ܶȻ�������֪��Һ��ͭ����Ũ����![]() ��2.2��10-4mol/L��
��2.2��10-4mol/L��

 ��У����ϵ�д�
��У����ϵ�д�