题目内容
【题目】工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32—(aq) ![]() PbCO3(s) + SO42—(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
PbCO3(s) + SO42—(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
D. 整个过程涉及一个复分解反应和两个氧化还原反应
【答案】C
【解析】
试题分析:A.根据方程式,PbCO3的溶解度小于PbSO4,故A错误;B. 处理PbSO4后,Na2CO3或NaHCO3溶液转变为硫酸钠溶液,pH降低,故B错误;C. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,碳酸氢钠的电离程度较小,碳酸根离子浓度较小,而碳酸钠中碳酸根离子浓度较大,Na2CO3溶液中的PbSO4转化率较大,故C正确;D. 整个过程涉及两个复分解反应:PbSO4(s) + CO32—(aq) ![]() PbCO3(s) + SO42—(aq)和PbCO3灼烧后获得PbO,一个氧化还原反应:PbO转变为Pb,故D错误;故选C。
PbCO3(s) + SO42—(aq)和PbCO3灼烧后获得PbO,一个氧化还原反应:PbO转变为Pb,故D错误;故选C。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某同学进行下列实验:
操作 | 现象 |
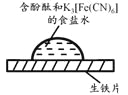
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
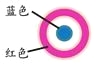
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 中心区:Fe–2e—==Fe2+
C. 边缘处:O2+2H2O+4e—==4OH—
D. 交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+