题目内容
【题目】硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
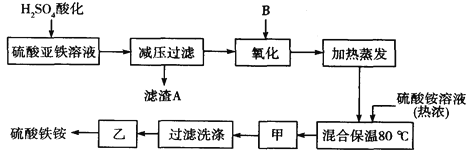
请回答下列问题:
(1)下列物质中最适合的氧化剂B是 ;
a.NaClO b.H2O2c.KMnO4d.K2Cr2O7
反应的离子方程式 。
(2)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,能否用酸性的KMnO4溶液?并说明理由 。(可用文字或方程式说明)
(3)检验硫酸铁铵中NH4+的方法是 。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
【答案】(1)b(3分);H2O2+2Fe2++2H+=2Fe3++2H2O(3分)
(2)不能,因为H2O2和Fe2+均能使酸性KMnO4溶液褪色(3分)
(3)在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色(3分) (4)Fe2(SO4)3·2(NH4)2SO4·2H2O(3分)
【解析】试题分析:(1)由于不能引入杂质,则选择绿色氧化剂双氧水,答案选b,反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。
(2)由于H2O2和Fe2+均能使酸性KMnO4溶液褪色,所以不能用酸性高锰酸钾溶液检验。
(3)铵盐能与氢氧化钠反应发生碱性气体氨气,则检验铵跟离子的实验方法是在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色。
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀,该沉淀是氢氧化铁,物质的量是2.14g÷107g/mol=0.02mol;向另一份溶液中加入含0.05 mol Ba (NO3)2的溶液,恰好完全反应,这说明硫酸根离子的物质的量是0.05mol,因此该硫酸铁铵中铁离子与硫酸根离子的个数之比是2:5,所以不含结晶水的化学式为Fe2(SO4)3·2(NH4)2SO4。每一份中结晶水的质量是7.00g—0.01mol×664g/mol=0.36g,物质的量是0.02mol,所以化学式为Fe2(SO4)3·2(NH4)2SO4·2H2O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4